Esclerose múltipla
| Esclerose múltipla | |
|---|---|
| Desmielinização causada pela EM. O tecido conjuntivo corado mostra vários macrófagos na área da lesão. Escala 1:100 | |
| Sinónimos | Esclerose em placas, esclerose disseminada, esclerose multilocular |
| Especialidade | Neurologia |
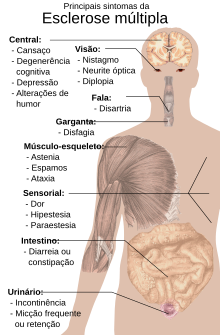
| Sintomas | Visão dupla, cegueira num dos olhos, fraqueza muscular, problemas sensoriais, problemas de coordenação[1] |
| Início habitual | 20–50 anos de idade[2] |
| Duração | Crónica[1] |
| Causas | Desconhecidas[3] |
| Método de diagnóstico | Baseado nos sintomas e exames médicos[4] |
| Tratamento | Medicação, fisioterapia[1] |
| Prognóstico | Diminuição de 5–10 anos da esperança de vida[5] |
| Frequência | 2 milhões (2015)[6] |
| Mortes | 18 900 (2015)[7] |
| Classificação e recursos externos | |
| CID-10 | G35 |
| CID-9 | 340 |
| OMIM | 126200 |
| DiseasesDB | 8412 |
| MedlinePlus | 000737 |
| eMedicine | neuro/228 oph/179 emerg/321 pmr/82 radio/461 |
| MeSH | D009103 |
Esclerose múltipla (EM) é uma doença desmielinizante de etiologia ainda desconhecida, caracterizada por uma reacção inflamatória na qual são danificadas as bainhas de mielina que envolvem os axónios dos neurónios cerebrais e medulares, levando à sua desmielinização e ao aparecimento de um vasto quadro de sinais e sintomas.[1][5] A doença manifesta-se geralmente em jovens adultos e é mais frequente em mulheres numa razão de cerca de 3:1.[5] A sua prevalência varia consoante a situação geográfica estudada, entre 2 e mais de 150 casos em cada 100 000 indivíduos, nos países tropicais e nos países nórdicos respetivamente .[8][9] A EM foi descrita pela primeira vez em 1868 por Jean-Martin Charcot.[10]
Devido a esta desmielinização, a EM afecta a capacidade das células nervosas do cérebro e da medula espinhal comunicarem entre si de forma eficaz. As células nervosas comunicam entre si através da transmissão de impulsos eléctricos, designados por potenciais de acção, ao longo dos seus filamentos extensos designados por axónios, os quais estão envolvidos por uma substância isolante chamada mielina. Na EM, o próprio sistema imunitário do corpo ataca e destrói a mielina. Uma vez destruída, os axónios deixam de poder transmitir o potencial de acção de um neurónio ao neurónio seguinte ficando assim a condução do estímulo nervoso interrompida.[11] O termo "esclerose múltipla" é uma referência às lesões, ou escleroses, que ocorrem sobretudo na substância branca do cérebro, cerebelo e medula espinal, que é constituída principalmente por fibras nervosas revestidas de mielina.[10] Embora sejam plenamente conhecidos os mecanismos envolvidos no desenvolvimento da doença, a causa é ainda desconhecida. As teorias plausíveis inclinam-se para uma causa genética, infecciosa ou muito provavelmente imunológica. Também foram identificados alguns factores de risco ambientais.[11][12][13]
A doença pode manifestar-se através de praticamente qualquer sintoma neurológico, dependente da localização da placa de desmielinização, e frequentemente evolui com a perda de capacidades físicas e cognitivas.[11] A EM pode assumir várias formas, e cada novo sintoma pode ocorrer em ataques discretos e isolados (forma recrudescente) ou os sintomas podem-se ir acumulando ao longo do tempo (forma progressiva).[14] Entre cada ataque, a sintomatologia pode desaparecer por completo, embora normalmente se verifiquem sequelas neurológicas permanentes, sobretudo à medida que a doença progride.[14]
Não se conhece uma cura eficaz contra a esclerose múltipla. O tratamento baseia-se na tentativa de melhoria das funções fisiológicas comprometidas depois de um ataque, na prevenção de novos episódios e na prevenção da degenerescência .[11] A medicação para a EM pode apresentar vários efeitos colaterais e mesmo ser mal tolerada pelo organismo, o que leva a que muitas pessoas procurem tratamentos alternativos, apesar da falta de evidências científicas que os confirmem. É difícil obter um prognóstico preciso; depende do sub-tipo da doença, da característica individual da doença, dos sintomas iniciais e do grau de degenerescência que o indivíduo apresenta à medida que a doença progride.[15] A esperança de vida em doentes de EM é de cerca de cinco a dez anos inferior à da restante população.[5]
Sinais e sintomas
O indivíduo com EM pode experimentar praticamente qualquer sinal ou sintoma neurológico, incluindo alterações sensoriais como a perda de sensibilidade táctil ou formigueiro, parestesia, fadiga muscular, clónus, espasmos musculares ou dificuldades locomotoras; dificuldades na coordenação e de equilíbrio (ataxia); dificuldades na fala (disartria) ou na deglutição (disfagia); problemas visuais tais como fosfeno, diplopia, nistagmo, na sequência de uma neurite óptica.[16][17] Fadiga, dor aguda ou crónica e dificuldades miccionais e do peristaltismo intestinal com obstipação secundária.[5] São também comuns vários graus de degradação da capacidade cognitiva, bem como sintomas de depressão nervosa e humor instável, alternando entre episódios de choro e de alegria eufórica.[5] São também característicos da EM, embora não exclusivos, fenómeno de Uhthoff, um agravamento dos sintomas em função da exposição a temperaturas superiores ao normal, e o sinal de Lhermitte, uma sensação de corrente eléctrica que irradia pela coluna vertebral ao dobrar o pescoço.[5]
Os sintomas da EM pioram normalmente durante episódios agudos de agravamento, designados por recaídas ou agudizações, ou devido a uma degenerescência progressiva e contínua das funções neurológicas, ou ainda uma conjugação de ambos.[14] As recaídas da EM são quase sempre imprevisíveis, ocorrem sem aviso prévio e sem causa aparente, a um ritmo raramente superior a um episódio e meio por ano.[5] Alguns ataques, no entanto, são antecedidos por estímulos comuns. As recaídas ocorrem com maior frequência durante a primavera e o verão.[18] As infecções virais, como a rinofaringite, gripe ou gastroenterite, aumentam o risco de novos episódios.[5] O stresse pode também desencadear um ataque.[19] A gravidez afecta a susceptibilidade às agudizações, baixando o ritmo de ocorrência a cada trimestre de gestação. Durante os primeiros meses após o parto, no entanto, é maior o risco de ocorrer um ataque.[5] De uma maneira geral, a gravidez não parece ter influência na degenerescência a longo prazo. Muitos dos potenciais estímulos foram já examinados e demonstrou-se que não têm influência no ritmo de ocorrência dos episódios. Não há qualquer evidência que a vacinação, a amamentação,[5] o trauma físico,[20] ou que o fenómeno de Ohthoff[18] sejam estímulos de ataques.
Para quantificar o grau de progressão das incapacidades ocorridas durante a evolução da doença e a gravidade dos sintomas usa-se habitualmente a escala expandida do estado de incapacidade (EDSS, do original expanded disability status scale).[21]
Causas
A esclerose múltipla é provavelmente consequência de uma determinada combinação de factores genéticos, ambientais e infecciosos,[5] e possivelmente outros factores, como problemas vasculares.[22] Os estudos epidemiológicos da EM têm fornecido indícios para possíveis causas da doença. As várias teorias tentam relacionar os dados até agora conhecidos com explicações plausíveis, embora nenhuma seja ainda definitiva.
Genética
A EM não é considerada uma doença hereditária. No entanto, tem-se verificado que algumas variações genéticas aumentam o risco de vir a desenvolver a doença.[23] O risco de contrair EM é maior nos familiares de um indivíduo com a doença do que na população em geral, em particular entre irmãos ou entre pais e filhos.[11] A doença apresenta uma taxa de recidiva familiar de 20%.[5] Em casos de gémeos monozigóticos, a concordância ocorre em 35% dos casos, enquanto que entre irmãos é de apenas 5% e ainda menor no caso de meios-irmãos. Isto demonstra que a susceptibilidade à doença é em parte poligénica,[5][11] e parece ser mais comum em certos grupos étnicos do que outros.[24]
Para além de estudos em famílias, têm sido associados à EM genes específicos. Diferenças no sistema do antigénio leucocitário humano (HLA) – um grupo de genes no cromossoma 6 que actuam nos seres humanos como complexo principal de histocompatibilidade (MHC) – aumentam a probabilidade de vir a sofrer de EM.[5] A descoberta mais consistente é a associação entre a EM e os alelos do MHC DR15 e DQ6.[5] Outras áreas têm demonstrado um efeito protector, como os HLA-C554 e HLA-DRB1*11.[5] Recentemente, a associação entre alelos HLA (classe II), especialmente a região DRB1, e outros genes, tais como o CIITA que é um transativador HLA.[25]
Factores ambientais
Têm sido propostos como factores de risco da EM diversos factores ambientais, tanto de origem infecciosa como não-infecciosa. Embora alguns sejam parcialmente modificáveis, só uma investigação mais aprofundada, sobretudo ensaios clínicos, é que pode demonstrar se a sua eliminação por completo pode ajudar a prevenir a EM.[26]
A prevalência da EM aumenta à medida que aumenta a latitude, embora existam excepções.[5] Tem-se associado a exposição a radiações solares menos agressivas e exposição a menor índice de calor a um risco acrescido de EM.[26] A diminuição da produção e ingestão de vitamina D tem sido o principal mecanismo biológico usado para explicar o risco acrescido entre os que estão expostos à menores índices de radiação solar.[26][27][28]
Embora as evidências sejam fracas, o stresse pode constituir um factor de risco.[26] É duvidoso se o tabagismo seria um factor de risco independente para vir a desenvolver EM.[27] Tem-se estudado a exposição em ambiente laboral a determinadas toxinas, sobretudo solventes, embora ainda não se tenha obtido conclusões claras.[26] As vacinas foram também investigadas enquanto prováveis factores de risco, embora a maior parte dos estudos mostre não existir qualquer associação entre a EM e a vacinação.[26] Foram também investigados vários outros possíveis factores de risco, inclusive o tipo de alimentação[29] e a ingestão de hormonas, embora as evidências da sua relação com a doença sejam escassas e pouco convincentes.[27]
Em um estudo, a gota ocorreu com menos frequência em indivíduos portadores EM, que apresentam níveis inferiores de ácido úrico quando comparados com o resto da população. Isto levou a que se propusesse que o ácido úrico poderia eventualmente oferecer uma protecção contra a EM, embora a sua importância em concreto seja ainda desconhecida.[30]
Infeções
Têm sido propostos vários agentes patogénicos como potenciais causas da EM, embora nenhum tenha sido comprovado.[11] Em idades muito jovens, a mudança de uma parte do mundo para outra altera o risco dessa pessoa vir a contrair EM.[12] Uma possível explicação para isto pode estar no facto da doença ter origem em algum tipo de infecção produzida por um micróbio amplamente disseminado, em vez de o ser por um agente patogénico raro.[12] Existe uma série de mecanismos propostos para a origem infecciosa, incluindo a hipótese da higiene e a hipótese da prevalência. A hipótese da higiene propõe que a exposição a vários agentes infecciosos durante os primeiros anos de vida oferece protecção contra a EM por estimulação do sistema imunitário.[5] A hipótese da prevalência propõe que a doença seja devida a um agente patogénico mais comum em regiões com alta prevalência de EM, onde na maior parte dos indivíduos cause apenas uma infecção persistente mas assintomática, causando a desmielinização só depois de muitos anos e apenas em alguns indivíduos.[12][31] A hipótese da higiene tem recebido mais apoio do que a hipótese da prevalência.[12]
Entre as evidências que apontam para as causas virais encontra-se a presença de bandas oligoclonais no cérebro e no fluido cerebroespinal da maior parte dos indivíduos com EM, a associação existente entre vários vírus e encefalomielites desmielizantes, e a indução de desmielinização em animais através de infecções virais.[32] Os vírus do herpes humano são também um grupo provável de ligação com a EM. Indivíduos que nunca tenham sido infectados pelo vírus Epstein-Barr apresentam um risco reduzido de vir a contrair a doença, e os que foram infectados em jovens adultos apresentam um risco maior do que aqueles que foram infectados em idades precoces.[5][12] Embora alguns considerem que isto contradiga a hipótese da higiene, uma vez que os não-infectados tiveram provavelmente uma melhor educação em termos de higiene,[12] outros acreditam que não há qualquer contradição uma vez que é a primeira exposição num momento tardio com o vírus responsável que espoleta a doença.[5] Têm também sido relacionadas com a EM outras doenças, como o sarampo, a papeira e a rubéola.[5]
Anomalias vasculares
Ultimamente, com as descobertas de Paolo Zamboni sobre a insuficiência venosa crónica cérebro-espinal e o achado na grande maioria destes pacientes de malformações venosas extra-cerebrais que dificultam a drenagem venosa cerebral, como estenoses das veias ázigos e jugulares, a hipótese do aumento da pressão venosa intra-cerebral, como factor desencadeante da doença, parece plausível. O facto da particular relação entre a prevalência e a distribuição geográfica da doença vem ao encontro desta hipótese na medida em que a vasoconstrição provocada pelo frio poderia agravar uma patologia vascular já existente mas ainda não significativa para desencadear a doença. No entanto, só o tempo e mais estudos sobre os resultados do tratamento cirúrgico destas malformações vasculares, que está a ser presentemente efectuado nestes pacientes, podem ser conclusivos.[13]
Fisiopatologia
Imunologia
Acredita-se que a esclerose múltipla seja uma doença imuno-mediada por uma série de interacções complexas entre a genética do indivíduo e factores ambientais ainda não identificados.[11] Pensa-se que as lesões sejam causadas pelo próprio sistema imunitário que reconhece e ataca auto-antígenos no sistema nervoso, como a proteína básica de mielina (MBP).[11]
Lesões
O termo "esclerose múltipla" refere-se às lesões, ou escleroses, que se formam no sistema nervoso. As lesões da EM afectam sobretudo as áreas de massa branca perto dos ventrículos do cerebelo, do tronco cerebral, dos gânglios da base, da medula espinal e do nervo óptico. A função das células da matéria branca é o transporte de sinais entre as áreas da massa cinzenta, onde é feito o seu processamento, e o resto do corpo. O sistema nervoso periférico raramente é afectado.[11]
Em detalhe, a EM destrói os oligodendrócitos, células responsáveis pela criação e manutenção da camada lipoproteica, designada bainha de mielina, que permite aos neurónios a transmissão dos impulsos eléctricos.[11] Isto tem como resultado a destruição ou o adelgaçamento da camada de mielina e, à medida que a doença progride, a degenerescência total dos axónios dos neurónios. Uma vez perdida a mielina, um neurónio deixa de ser capaz de conduzir os impulsos eléctricos de forma eficaz.[11] Durante os estágios iniciais da doença, o corpo desencadeia um processo regenerativo, designado remielinização, embora os oligodendrócitos não sejam capazes de reconstruir por completo o revestimento de mielina das células.[33] A frequência das agudizações da doença leva a que haja cada vez menos remielinizações bem sucedidas, até que se forma uma placa de tecido fibroso à volta dos axónios danificados.[33] Foram já descritos vários padrões de lesões.[34]
Processo inflamatório
Para além da desmielinização, a outra característica patológica da doença é a reação inflamatória. Descrita de um ponto de vista estritamente imunulógico, a EM é um processo inflamatório com origem nos linfócitos T. Os linfócitos são células que desempenham um papel fundamental nas defesas do corpo.[11] Na EM, os linfócitos T conseguem penetrar no cérebro através de rupturas na barreira hematoencefálica. As evidências de modelos animais apontam também para a implicação dos linfócitos B, em conjunto com os linfócitos T, no desenvolvimento da doença.[35]
Os linfócitos T interpretam a mielina como um corpo estranho e atacam-na como se se tratasse de um vírus invasor. Esta acção, por sua vez, desencadeia processos inflamatórios, estimulando outras células defensivas e a produção de citocinas e anticorpos. Formam-se novas rupturas na barreira hematoencefálica, que por sua vez causa uma série de outros efeitos nocivos, como o edema, a activação de macrófagos, e a secreção de mais citocinas e outras proteínas destrutivas.[11]
Ruptura da barreira hematoencefálica
A barreira hematoencefálica é uma camada endotelial espessa e dificilmente permeável, que recobre os capilares do sistema nervoso central e isola-os impedindo a passagem de determinadas substâncias ou células do sangue para o fluido cerebral extra-capilar como os linfócitos T. É um filtro extremamente seletivo.[36] No entanto, pode tornar-se permeável a este tipo de células, como consequência de um processo inflamatório ou infeccioso, bacteriano ou viral.[11] Quando a barreira recupera a sua integridade, os linfócitos T ficam aprisionados dentro do cérebro.[11]
Diagnóstico
A esclerose múltipla pode ser difícil de diagnosticar, uma vez que partilha sinais e sintomas com várias outras condições clínicas.[5][37] As instituições médicas têm vindo a elaborar uma série de critérios de diagnóstico de modo a facilitar e padronizar todo o processo, sobretudo durante os primeiros estágios da doença.[5] Até há pouco tempo, os métodos mais populares eram os critérios de Schumacher e de Poser.[38]
Actualmente, os critérios de McDonald focam-se na demonstração da presença da doença através de dados clínicos, radiológicos e laboratoriais da disseminação das lesões características da EM no espaço e no tempo, sendo estes dados recolhidos de forma não-invasiva. No entanto, algumas fontes referem que a única forma de obter um diagnóstico definitivo de EM é através de uma autópsia, ou em alguns casos biópsia, onde essas mesmas lesões podem ser confirmadas através de técnicas histopatológicas.[5][39][40]
Os dados clínicos por si só podem ser suficientes para o diagnóstico de EM em casos de indivíduos que tenham sofrido episódios isolados de sintomas neurológicos característicos da EM.[39] Uma vez que algumas pessoas procuram cuidados médicos depois do primeiro ataque, outro tipo de exames pode acelerar e facilitar o diagnóstico. As ferramentas de diagnóstico mais comuns são a neuroimagiologia, a análise ao líquido cefalorraquidiano e os potenciais evocados. As áreas onde ocorre desmielinização (através de lesões ou placas) podem ser observadas através de ressonâncias magnéticas ao cérebro e à medula espinal. Pode ser administrado contraste por via intravenosa, normalmente gadolínio, de modo a salientar as placas activas e demonstrar também a presença de lesões anteriores que não estejam associadas com os sintomas no momento do exame.[39][41] A análise do líquido cefalorraquidiano, recolhido através de uma punção lombar, pode confirmar a presença de inflamações crónicas do sistema nervoso central, confirmando a presença ou ausência de bandas oligocionais de IgG na amostra, que são marcadores inflamatórios encontrados em 75 a 85% dos portadores de EM.[39][42] O sistema nervoso de uma pessoa com EM é menos reactivo ao estímulo do nervo óptico e dos nervos sensoriais devido à desmielinização das vias nervosas. A reacção do cérebro pode ser examinada através de potenciais evocados visuais e sensoriais.[43]
Classificação
A EM é classificada segundo vários subtipos, ou padrões de progressão, que permitem prever a evolução da doença através da análise do padrão de progressão passado. São importantes não só para o prognóstico, mas também para decisões de terapêutica. Em 1996 a National Multiple Sclerosis Society definiu quatro subtipos padrão de EM:[14]
- Esclerose Múltipla Recidivante Remitente (EMRR);
- Esclerose Múltipla Secundária Progressiva (EMSP);
- Esclerose Múltipla Primária Progressiva (EMPP);
- Esclerose Múltipla Primária Recidivante (EMPR).
O subtipo recidivante remitente (EMRR) é caracterizado por recidivas imprevisíveis, seguidas de um período de meses ou anos de relativa tranquilidade (remitência) sem novos sintomas da actividade da doença. Os défices neurológicos que ocorrem durante os ataques podem desaparecer por si mesmo ou deixar sequelas, sendo a última situação mais comum em função do tempo decorrido.[5] Isto corresponde ao estágio inicial de 80% dos indivíduos com EM.[5] Quando os défices neurológicos desaparecem por si próprios entre os ataques, o fenómeno é por vezes designado de "esclerose múltipla benigna",[44] embora a longo prazo o indivíduo venha na mesma a sofrer de algum grau de incapacidade.[5] O subtipo recidivante remitente tem normalmente início com uma síndrome clínica isolada (SCI), durante a qual um indivíduo é afectado por um ataque que sugere desmielinização, embora não cumpra os critérios para esclerose múltipla.[5][45] No entanto, apenas 30 a 70% dos indivíduos que sofrem um SCI é que mais tarde desenvolvem EM.[45]
A esclerose múltipla secundária progressiva (EMSP) corresponde a cerca de 65% dos casos em que existe esclerose recidivante remitente durante os estágios iniciais, e que a partir de determinado momento começam a sofrer declínio neurológico entre os episódios agudos de ataques, sem existirem quaisquer períodos claros de remissão.[5][14] Podem aparecer recidivas ocasionais e remissões menores.[14] O tempo médio que decorre entre o aparecimento da doença e a conversão de EM recidivante remitente em EM secundária progressiva é de dezanove anos.[46]
A esclerose múltipla primária progressiva (EMPP) corresponde a aproximadamente 10 a 15% dos indivíduos que nunca tiveram remissão após os sintomas iniciais de EM.[47] Caracteriza-se pela progressão contínua do grau de incapacidade a partir do aparecimento da doença, com poucas ou nenhumas remissões ou melhorias.[14] A idade média em que o subtipo primário progressivo aparece é superior à do subtipo recidivante remitente, embora seja semelhante à idade média de progressão de recidivante remitente para secundária progressiva. Em ambos os casos perto dos quarenta anos de idade.[5]
A esclerose múltipla primária recidivante (EMPR) descreve os indivíduos que, desde o aparecimento da doença, demonstram um declínio neurológico constante, mas para além disso sofrem ataques adicionais. Este é o subtipo mais raro entre todos.[14]
Existem também variantes atípicas de EM, entre elas a neuromielite óptica, a esclerose concêntrica de Baló, a esclerose difusa e a variante de Marburg. Existe um debate sobre se estas patologias são variantes da EM ou constituem doenças autónomas.[48] A EM progride também de forma diferente em crianças e leva mais tempo a atingir a fase progressiva,[5] sendo a idade média a que ocorre a transição inferior à dos adultos.[5]
Tratamento
Embora não seja conhecida qualquer cura para a esclerose múltipla, há várias terapias que ajudam a mitigar os efeitos da doença. Os principais objectivos da terapia são o restabelecimento das funções do paciente após um episódio de ataque, a prevenção de novos ataques e a prevenção da degenerescência. À semelhança de qualquer terapêutica, a medicação usada na gestão da EM apresenta diversos efeitos secundários. Algumas pessoas procuram o apoio de terapias alternativas, apesar da escassez de estudos científicos comparativos e replicáveis que as comprovem.
Medicamentos que melhoram o surto agudo
Durante os episódios sintomáticos, a terapia de rotina para as recidivas é a administração de doses elevadas de corticosteróides por via intravenosa.[5] Embora geralmente eficazes no alívio de sintomas a curto prazo, o tratamento com corticosteróides não aparenta ter impacto significativo no recobro a longo prazo.[49] Tanto a administração oral como a intravenosa parecem ter o mesmo grau de eficácia.[50] As consequências de ataques graves que não respondam aos corticosteróides podem ser tratadas através de plasmaferese.[5]
Medicamentos modificadores da doença
O uso de fingolimod (marca comercial: Gilenya) para o tratamento da EM foi aprovado nos Estados Unidos em 2010 e na Europa em 2011. Estão actualmente disponíveis seis medicamentos de combate à doença aprovados por entidades reguladoras de vários países, sendo os outros cinco: o Interferão beta-1a (marcas comerciais: Avonex, CinnoVex, ReciGen e Rebif) e o Interferão beta-1b (marca comercial: Betaferon na Europa e no Japão, e Betaseron nos Estados Unidos). O terceiro medicamento disponível é o acetato de glatirâmero (Copaxone), um imunomodulador não-esteróide e não-interferão. O quarto medicamento é a mitoxantrona, um imunossupressor também usado na quimioterapia do cancro. O quinto é o natalizumab (comercializado como Tysabri), um imunomodulador de anticorpos monoclonais humanizado. Os interferões e o acetato de glatirâmero são administrados através de injecções frequentes, variando entre uma dose diária para o acetato de glatirâmero até uma injecção semanal intra-muscular de Avonex. O natalizumab e a mitoxantrona são administrados através de infusões intravenosas em intervalos mensais.[5]
Todos os seis tipos de fármacos demonstram eficácia moderada na redução do número de ataques na EM recidivante remitente (EMRR), embora a capacidade dos interferões e do acetato de glatirâmero seja controversa e sejam ainda poucos os ensaios relativos aos seus efeitos a longo prazo.[5][51] Os comparativos entre imunomoduladores (à excepção da mitoxantrona) revelam que o mais eficaz é o natalizumab, tanto em termos de redução da frequência das recidivas como no atraso da progressão da degenerescência.[52] A mitoxantrona pode ser o mais eficaz entre todos; no entanto, não é considerada uma terapia de longo prazo uma vez que o seu uso é restringido por efeitos secundários graves.[5][51] A primeira manifestação clínica de EMRR é a síndrome clínica isolada (SCI). O tratamento com interferões durante o ataque inicial pode diminuir as hipóteses dessa pessoa vir a desenvolver EM clínica.[5]
O tratamento da EM progressiva é mais difícil do que a EMRR. A mitoxantrona demonstrou ter alguns efeitos benéficos em indivíduos com EM secundária progressiva e primária recidivante. É ainda moderadamente eficaz na redução da progressão da doença e na frequência das recidivas a curto prazo.[53] Não há ainda nenhum tratamento que se tenha demonstrado eficaz na alteração do progresso da EM primária progressiva.[54]
À semelhança de outras terapêuticas, estes tratamentos têm vários efeitos secundários. Um dos mais comuns é a irritação na área da injecção no caso do acetato de glatirâmero do tratamento com interferões. Com o decorrer do tempo, pode-se desenvolver na mesma área uma cavidade visível designada lipoatrofia, em consequência da destruição local do tecido adiposo. Os interferões estão também na origem de sintomas semelhantes aos da gripe.[55] Alguns pacientes que tomam glatirâmero desenvolvem após a injecção uma reacção cujos sintomas incluem rubor, sensação de aperto no peito, palpitações cardíacas, falta de ar e ansiedade que normalmente duram menos de trinta minutos.[56] Mais perigosas, embora muito mais raras, são as lesões hepáticas causadas pelos interferões,[57] a cardiotoxicidade, a infertilidade e a leucemia mieloide aguda causadas pela mitoxantrona,[5][51] e a ligação entre o natalizumab e alguns casos de leucoencefalopatia multifocal progressiva.[5]
Gestão dos efeitos
Os medicamentos modificadores da doença diminuem a progressão da doença, mas não a param. À medida que a esclerose múltipla progride, a sintomatologia tende a aumentar. A doença está associada a uma série de sintomas e de défices funcionais que estão na origem de um vasto espectro de progressiva debilidade e deficiência. Gerir estes défices é bastante importante. As terapias farmacológicas e a neuroreabilitação aliviam o fardo de certos sintomas, embora nenhuma tenha qualquer influência na progressão da EM.[5][58] Alguns sintomas respondem de forma adequada à medicação, como a bexiga irritada ou a espasticidade, enquanto outros são de gestão bastante mais complexa.[5] Tal como acontece em qualquer indivíduo com défices neurológicos, uma abordagem multidisciplinar é a chave para melhorar a qualidade de vida. No entanto, há dificuldade em criar uma equipa de acompanhamento, uma vez que o paciente de EM vai requerer ajuda de praticamente qualquer especialidade médica a determinada altura.[5] Os programas multidisciplinares de reabilitação aumentam a actividade e a participação de pessoas com EM, mas não têm influência no grau de deficiência.[59]
No passado, os portadores de EM eram aconselhados a não participar em actividades físicas com receio que isso agravasse os sintomas.[60] No entanto, caso seja feita sob a orientação de um fisioterapeuta, a participação em actividades físicas pode ser segura e tem-se mostrado benéfica para as pessoas com EM.[61] A investigação tem suportado o papel reabilitador da actividade física ao melhorar a resistência muscular,[62] a mobilidade,[62] a disposição,[63] a saúde intestinal e[64] e sensação geral de bem estar e de qualidade de vida.[62] Deve ser tomado especial cuidado em não sobreaquecer uma pessoa com EM durante a realização de exercício físico. Os fisioterapeutas têm as competências necessárias para prescrever programas de exercício adequados ao paciente.[61] Dependendo da pessoa, as actividades podem incluir treino de resistência,[65] caminhadas, natação e ioga.[64] Determinar um programa adequado e seguro é difícil e deve ser personalizado de forma cuidada, levando em conta todas as contra indicações e precauções.[61] Há algumas evidências que sustentam que determinadas medidas de arrefecimento são eficazes em permitir exercício físico mais intenso.[66]
Tratamentos alternativos
Muitas pessoas com EM recorrem a tratamentos complementares e à medicina alternativa. Dependendo do tratamento, as evidências que demonstram a sua eficácia são mal sustentadas ou inexistentes.[67] Entre os métodos recorrentes estão a dieta de Swank, baixa em gorduras saturadas,[68] as plantas medicinais (incluindo o uso de cannabis medicinal),[69] a oxigenoterapia hiperbárica[70] e a auto-infecção com os parasitas da ancilostomíase, conhecida como terapia helmíntica.[71]
Prognóstico
O prognóstico de uma pessoa com esclerose múltipla depende do subtipo da doença, de características individuais como o sexo, idade e sintomas iniciais, e do grau de incapacidade que afecta essa pessoa.[15] A doença progride e regride ao longo de várias décadas, correspondendo a uma esperança média de vida de trinta anos a partir do seu aparecimento.[5]
Há uma série de factores que têm vindo a ser associados a um prognóstico mais favorável da progressão da doença, como o sexo feminino, o subtipo recidivante remitente, a neurite óptica ou sintomas neurológicos no estágio inicial, um número reduzido de ataques nos primeiros anos e, sobretudo, o início da doença em idade jovem.[15][72]
A esperança de vida de indivíduos com EM é de cinco a dez anos inferior à média da população não afectada.[5] Cerca de 40% dos portadores de EM chegam à sétima década de vida.[72] No entanto, dois terços dos óbitos em pessoas com EM estão directamente relacionados com consequências da doença.[5] O suicídio tem também maior prevalência em relação à população saudável, enquanto que as infecções são particularmente perigosas para aqueles com maior grau de degenerescência .[5]
Embora a maior parte dos portadores venha a perder a capacidade de locomoção autónoma antes da morte, 90% são ainda capazes de caminhar dez anos depois do aparecimento da doença e 75% quinze anos depois.[72][73]
Epidemiologia
As duas principais medidas usadas nos estudos epidemiológicos são a incidência e a prevalência. A incidência é o número de novos casos por determinado número de pessoas em risco e em determinado intervalo de tempo (normalmente, o número de novos casos por cada mil indivíduos a cada ano). A prevalência é o número total de casos da doença entre a população em determinada data.[74]
A prevalência depende não só da incidência, como também da taxa de sobrevivência e das migrações de indivíduos afectados. A EM tem uma prevalência de 2 a 150 por cada 100 000 indivíduos, dependendo do país ou da população em análise.[9] Em Portugal a prevalência é estimada em cinquenta casos por cada cem mil habitantes.[75] No Brasil, dependendo da região pode ir de 4,41 a 19 casos por 100 000 habitantes.[76] Tem sido frequente a elaboração de estudos sobre os padrões populacionais e geográficos das medidas epidemiológicas em relação à EM,[31] o que tem levado à proposta de várias teorias etiológicas em relação à causa da patologia.[12][26][27][31]
A EM normalmente aparece em adultos na casa dos 30 anos, embora também possa aparecer em crianças.[5] O subtipo primário progressivo é mais frequente em pessoas na casa dos 50.[47] À semelhança de outros distúrbios autoimunes, a doença é mais frequente em mulheres, tendência que aparenta ter vindo a aumentar.[5][77] Esta proporção entre sexos é ainda mais acentuada em crianças,[5] enquanto que em indivíduos com idade superior a 50 anos a EM afecta ambos os sexos de forma equivalente.[47]
Há uma diminuição da prevalência de norte para sul no hemisfério norte e de sul para norte no hemisfério sul, sendo a doença muito menos frequente nos habitantes dos países próximos do equador.[5][77] O clima, a exposição solar e a ingestão de vitamina D têm sido investigados enquanto causas prováveis para a explicação desta variação em termos de latitude.[27] No entanto, há excepções notáveis ao padrão norte-sul, assim como alterações nas taxas de prevalência ao longo do tempo.[5] No geral, esta tendência parece estar a desaparecer.[77] Isto indica que para a determinação da causa da EM devem ser considerados outros factores ambientais e genéticos.[5] A EM é também mais comum em regiões onde a população tenha origem norte-europeia.[5] Mas mesmo em regiões onde a EM é comum, alguns grupos étnicos demonstram menor risco de vir a desenvolver a doença, como os lapões, os turcomenos, os povos ameríndios, os huteritas canadianos, os povos africanos e os maori neozelandeses.[78]
Alguns factores ambientais durante a infância podem também desempenhar um papel importante no desenvolvimento de EM em idade posterior. Vários estudos em migrantes mostram que em migrações realizadas antes de completar quinze anos de idade, o migrante adquire a susceptibilidade da nova região à EM. Caso a migração ocorra depois dos quinze anos, o migrante mantém a mesma susceptibilidade da sua região de origem.[5][26] No entanto, o risco pode-se alargar a um intervalo de idades maior.[5] Tem-se também verificado uma relação entre a EM e a estação do ano em que se dá o nascimento, facto que tem vindo a sustentar a sua relação com a luz solar e a vitamina D. Por exemplo, nascem menos portadores de EM em Novembro em comparação com Maio.[79]
História
O neurologista francês Jean-Martin Charcot (1825–1893) foi a primeira pessoa a reconhecer a esclerose múltipla como doença distinta em 1868.[80] Através da revisão de relatórios anteriores e das suas próprias observações clínicas e patológicas, Charcot designou a doença "esclerose em placas". Os três sinais de EM, conhecidos hoje em dia como tríade de Charcot, são o nistagmo, tremor intencional e fala telegráfica, embora não sejam exclusivos da EM. Charcot observou também alterações cognitivas, ao descrever nos seus pacientes "nítido enfraquecimento de memória" e "formação lenta de concepções".[10]
Já antes de Charcot, Robert Carswell (1793–1857), professor britânico de patologia, e Jean Cruveilhier (1791–1873), professor francês de anatomia patológica, tinham descrito e ilustrado vários dos detalhes clínicos da doença, embora não a tenham identificado como doença autónoma.[80] Carswell descreveu as lesões por si observadas como "lesões notáveis da medula espinal acompanhadas de atrofia".[5] O patologista suiço Georg Eduard Rindfleisch (1836–1908), através de observações microscópicas, fez notar em 1863 que as lesões associadas a inflamações se distribuíam em volta dos vasos sanguíneos.[81][82]
Posteriormente à descrição de Charcot, Eugène Devic (1858–1930), Jozsef Balo (1895–1979), Paul Ferdinand Schilder (1886–1940) e Otto Marburg (1874–1948) descreveram os casos especiais da doença. Ao longo de todo o século XX foram sendo propostas várias teorias relativas à causa e patogénese da EM, embora os primeiros tratamentos eficazes só tenham surgido a partir de 1990.[5]
Investigação
Terapias
As principais linhas de investigação no tratamento de EM estão orientadas para pesquisa da patogenia e heterogenia da EM; para a procura de tratamentos mais cómodos, eficazes e toleráveis para a EMRR; para a criação de terapias para os sub-tipos progressivos; para estratégias de neuroprotecção; e para a procura de tratamentos eficazes dos sintomas.[83] Estão a ser investigados vários tratamentos que limitam os efeitos dos ataques ou que atenuam a perda de funções. Entre os agentes para o tratamento da EMRR que se têm mostrado promissores em segundas fases de ensaios clínicos estão o alemtuzumab (marca comercial Campath), daclizumab (marca comercial Zenapax), rituximab, dirucotide, BHT-3009, cladribina, fumarato de dimetilo, estriol, laquinimod, peginterferão beta-1a,[84] minociclina, estatinas, tensirolímus e teriflunomide.[83]
Em 2010, uma comissão da FDA recomendou a aprovação de fingolimod para o tratamento de ataques de EM,[85] tornando-se em setembro do mesmo ano (sob a marca comercial Gilenya) o primeiro fármaco de administração oral aprovado para reduzir as recidivas e retardar a progressão da degenerescência em indivíduos com formas recorrentes de EM.[86] Os ensaios clínicos de fingolimod demonstraram a ocorrência de efeitos secundários, entre os quais problemas cardiovasculares, edema macular, infecções, toxicidade hepática e casos de malignidade.[87][88]
Tem havido bastante interesse na perspectiva de utilização de análogos de vitamina D na prevenção e controlo da EM, dado o seu possível papel na patogénese da doença. Embora haja evidências anedóticas dos benefícios da administração de pequenas doses de naltrexona,[89] só foram publicados resultados de um estudo piloto em casos de EM primária recidivante.[90]
Biomarcadores
A variedade de manifestações clínicas da EM e a inexistência de exames laboratoriais de diagnóstico estão na origem de atrasos e da impossibilidade de obter diagnósticos preventivos. Estão a ser investigados novos meios de diagnóstico, nos quais se inclui o trabalho com anticorpos anti-mielina, a análise de microarrays de expressões génicas e estudos com soro e líquido cefalorraquidiano, embora nenhum deles tenha mostrado ainda resultados positivos de confiança.[91]
Actualmente, não existem métodos laboratoriais acreditados que possam prever o diagnóstico. No entanto, têm vindo a ser propostas várias abordagens promissoras. A investigação sobre a possibilidade de prever a evolução da doença tem-se centrado na monitorização da sua actividade. Os biomarcadores de activação da EM englobam a interleucina 6, o óxido nítrico, a óxido nítrico sintase, a osteopontina e a fetuína-A.[91] Por outro lado, uma vez que a progressão da doença é o resultado de neurodegeneração, está a ser investigado o papel de proteínas que indicam a perda de neurónios, axónios e neuróglia, como neurofilamentos, proteína tau, ácido N-acetilaspártico.[91]
Insuficiência venosa crónica cérebro-espinal
Em 2008, o cirurgião vascular Paolo Zamboni divulgou dados de investigação que sugeriam a relação da EM com uma patologia vascular que designou por insuficiência venosa crónica cérebro-espinal (em inglês: CCSVI), no qual se verifica um estreitamento das principais veias de drenagem cerebral e medular, nomeadamente as veias jugujares e a veia ázigos. Esta situação leva a um aumento da pressão venosa intra-cerebral e subsequente aumento da pressão do líquido céfalo-raquídeo. Zamboni verificou a ocorrência de CCSVI na maioria dos seus pacientes com EM, alegando que 73% deles apresentaram melhorias depois de uma intervenção cirúrgica para corrigir o problema.[13] Foram levantadas algumas controvérsias relativas à investigação de Zamboni, alegando que não houve ensaios cegos ou controlados,[92] ao mesmo tempo que estudos posteriores demonstraram resultados variáveis.[93] Isto deu origem a objecções em relação à hipótese de a CCSVI estar na origem de esclerose múltipla.[94] O tratamento cirúrgico das lesões estenóticas venosas, seria aconselhado mesmo na ausência de EM. No entanto mais estudos são necessários para que este tratamento seja considerado de eleição para a EM, como os próprios investigadores reconhecem.[95] Entretanto, dado o prognóstico e a esperança de vida dos doentes com EM, esta pequena cirurgia está já a ser efetuada, mesmo que a título experimental, em inúmeros centros como no Hospital Saint-Louis em Lisboa. A cirurgia é simples, pequena dilatação da veia estenosada por angioplastia e colocação de stent se necessário, não sendo ético privar estes pacientes de um tratamento que pode alterar para melhor a qualidade e esperança de vida.[96]
Potenciais novos tratamentos com auto-antígeno
Pesquisadores há muito suspeitam que um auto-antígeno - uma molécula normal no corpo que o sistema imunológico erroneamente trata como uma ameaça - pode desencadear a esclerose múltipla. Os principais suspeitos são proteínas na mielina, o isolamento nervoso que corrói os pacientes com a doença. Os pesquisadores analisaram células do sistema imunológico conhecidas como células T, provenientes de um paciente que morreu de EM. As células T normalmente ligam quando encontram fragmentos de proteínas contendo apenas alguns aminoácidos que pertencem a um micróbio invasor, mas também se ligam em pessoas que têm esclerose múltipla. Eles testaram 200 misturas de fragmentos contendo 300 bilhões de variedades cada. Os dois fragmentos com o efeito mais forte acabaram por fazer parte de uma enzima humana chamada sintase guanosina difosfato-L-fucose, que ajuda as células a remodelar os açúcares que estão envolvidos em tudo, desde o armazenamento de memórias até a determinação do nosso tipo sanguíneo. Células T de 12 dos 31 pacientes que tinham sido diagnosticados com EM ou apresentaram sintomas precoces da doença também reagiram à enzima.[97] As células T de quatro dos oito pacientes testados responderam a uma versão bacteriana da enzima - dando credibilidade à ideia recentemente proposta de que as bactérias intestinais podem ajudar a desencadear a doença.[98] Os pesquisadores acham que se a sintase guanosina difosfato-L-fucose se tornar um dos elusivos auto-antígenos da EM, dosar pacientes com ela pode reduzir sintomas como dormência e fraqueza muscular da mesma forma que as injeções de alergia impedem as pessoas de reagir substâncias como o pólen.[99]
Referências
- ↑ a b c d «NINDS Multiple Sclerosis Information Page». National Institute of Neurological Disorders and Stroke. 19 de novembro de 2015. Consultado em 6 de março de 2016. Arquivado do original em 13 de fevereiro de 2016
- ↑ Milo R, Kahana E (março de 2010). «Multiple sclerosis: geoepidemiology, genetics and the environment». Autoimmunity Reviews. 9 (5): A387-94. PMID 19932200. doi:10.1016/j.autrev.2009.11.010
- ↑ Nakahara J, Maeda M, Aiso S, Suzuki N (fevereiro de 2012). «Current concepts in multiple sclerosis: autoimmunity versus oligodendrogliopathy». Clinical Reviews in Allergy & Immunology. 42 (1): 26–34. PMID 22189514. doi:10.1007/s12016-011-8287-6
- ↑ Tsang BK, Macdonell R (dezembro de 2011). «Multiple sclerosis- diagnosis, management and prognosis». Australian Family Physician. 40 (12): 948–55. PMID 22146321
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae afag ah ai aj ak al am an ao ap aq ar as at au av aw ax ay az ba bb bcbd be bf bg Compston A, Coles A (outubro de 2008). «Multiple sclerosis». Lancet. 372 (9648): 1502–17. PMID 18970977. doi:10.1016/S0140-6736(08)61620-7
- ↑ GBD 2015 Disease and Injury Incidence and Prevalence Collaborators (outubro de 2016). «Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990–2015: a systematic analysis for the Global Burden of Disease Study 2015». Lancet. 388 (10053): 1545–1602. PMC 5055577
 . PMID 27733282. doi:10.1016/S0140-6736(16)31678-6
. PMID 27733282. doi:10.1016/S0140-6736(16)31678-6 - ↑ GBD 2015 Mortality and Causes of Death Collaborators (outubro de 2016). «Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980–2015: a systematic analysis for the Global Burden of Disease Study 2015». Lancet. 388 (10053): 1459–1544. PMC 5388903
 . PMID 27733281. doi:10.1016/s0140-6736(16)31012-1
. PMID 27733281. doi:10.1016/s0140-6736(16)31012-1 - ↑ «The prevalence of multiple sclerosis in the world: an update» (PDF). Consultado em 23 de janeiro de 2012. Arquivado do original (PDF) em 13 de dezembro de 2010
- ↑ a b Rosati G (abril de 2001). «The prevalence of multiple sclerosis in the world: an updata». Neurol. Sci. 22 (2): 117–39. PMID 11603614. doi:10.1007/s100720170011
- ↑ a b c Clanet M (junho de 2008). «Jean-Martin Charcot. 1825 to 1893» (PDF). Int MS J. 15 (2): 59–61. PMID 18782501
* Charcot, J. (1868). «Histologie de la sclerose en plaques». Gazette des hopitaux, Paris. 41: 554–5 - ↑ a b c d e f g h i j k l m n o p Compston A, Coles A (abril de 2002). «Multiple sclerosis». Lancet. 359 (9313): 1221–31. PMID 11955556. doi:10.1016/S0140-6736(02)08220-X
- ↑ a b c d e f g h Ascherio A, Munger KL (abril de 2007). «Environmental risk factors for multiple sclerosis. Part I: the role of infection». Ann. Neurol. 61 (4): 288–99. PMID 17444504. doi:10.1002/ana.21117
- ↑ a b c Zamboni P, Galeotti R, Menegatti E; et al. (abril de 2009). «Chronic cerebrospinal venous insufficiency in patients with multiple sclerosis». J. Neurol. Neurosurg. Psychiatr. 80 (4): 392–9. PMC 2647682
 . PMID 19060024. doi:10.1136/jnnp.2008.157164
. PMID 19060024. doi:10.1136/jnnp.2008.157164 - ↑ a b c d e f g h Lublin FD, Reingold SC (abril de 1996). «Defining the clinical course of multiple sclerosis: results of an international survey. National Multiple Sclerosis Society (USA) Advisory Committee on Clinical Trials of New Agents in Multiple Sclerosis». Neurology. 46 (4): 907–11. PMID 8780061
- ↑ a b c Weinshenker BG (1994). «Natural history of multiple sclerosis». Ann. Neurol. 36 (Suppl): S6–11. PMID 8017890. doi:10.1002/ana.410360704
- ↑ Davis FA, Bergen D, Schauf C, McDonald I, Deutsch W (novembro de 1976). «Movement phosphenes in optic neuritis: a new clinical sign». Neurology. 26 (11): 1100–4. PMID 988518
- ↑ Page NG, Bolger JP, Sanders MD (janeiro de 1982). «Auditory evoked phosphenes in optic nerve disease». J. Neurol. Neurosurg. Psychiatr. 45 (1): 7–12. PMC 491258
 . PMID 7062073. doi:10.1136/jnnp.45.1.7
. PMID 7062073. doi:10.1136/jnnp.45.1.7 - ↑ a b Tataru N, Vidal C, Decavel P, Berger E, Rumbach L (2006). «Limited impact of the summer heat wave in France (2003) on hospital admissions and relapses for multiple sclerosis». Neuroepidemiology. 27 (1): 28–32. PMID 16804331. doi:10.1159/000094233
- ↑ Heesen C, Mohr DC, Huitinga I; et al. (março de 2007). «Stress regulation in multiple sclerosis: current numeros and concepts». Mult. Scler. 13 (2): 143–8. PMID 17439878. doi:10.1177/1352458506070772
- ↑ Martinelli V (2000). «Trauma, stress and multiple sclerosis». Neurol. Sci. 21 (4 Suppl 2): S849–52. PMID 11205361. doi:10.1007/s100720070024[ligação inativa]
- ↑ Kurtzke JF (1983). «Rating neurologic impairment in multiple sclerosis: an expanded disability status scale (EDSS)». Neurology. 33 (11): 1444–52. PMID 6685237
- ↑ Minagar A, Jy W, Jimenez JJ, Alexander JS. (abril de 2006). «Multiple sclerosis as a vascular disease» (PDF). Neurol Res. 28 (3): 230–5. PMID 16687046. doi:10.1179/016164106X98080. Consultado em 20 de setembro de 2012. Arquivado do original (PDF) em 16 de agosto de 2011
- ↑ Dyment DA, Ebers GC, Sadovnick AD (fevereiro de 2004). «Genetics of multiple sclerosis». Lancet Neurol. 3 (92): 104–10. PMID 14747002. doi:10.1016/S1474-4422(03)00663-X
- ↑ «Who gets MS?». Multiple Sclerosis Trust. 30 de dezembro de 2009. Consultado em 18 de abril de 2011
- ↑ «Multiple sclerosis susceptibility in a Brazilian sample, HLA and CIITA genes». Arq. Neuro-Psiquiatr.; 72(6); 482-482; 2014-06. doi:http://dx.doi.org/10.1590/0004-282X20140036 Verifique
|doi=(ajuda) - ↑ a b c d e f g h Marrie RA (dezembro de 2004). «Environmental risk factors in multiple sclerosis aetiology». Lancet Neurol. 3 (12): 709–18. PMID 15556803. doi:10.1016/S1474-4422(04)00933-0
- ↑ a b c d e Ascherio A, Munger KL (junho de 2007). «Environmental risk factors for multiple sclerosis. Part II: Noninfectious factors». Ann. Neurol. 61 (6): 504–13. PMID 17492755. doi:10.1002/ana.21141
- ↑ Ascherio A, Munger KL, Simon KC (junho de 2010). «Vitamin D and multiple sclerosis». Lancet Neurol. 9 (6): 599–612. PMID 20494325. doi:10.1016/S1474-4422(10)70086-7
- ↑ Ghadirian P, Jain M, Ducic S, Shatenstein B, Morisset R (1998). «Nutritional factors in the aetiology of multiple sclerosis: a case-control study in Montreal, Canada». Int J Epidemiol. 27 (5): 845–52. PMID 9839742. doi:10.1093/ije/27.5.845
- ↑ Spitsin S, Koprowski H (2008). «Role of uric acid in multiple sclerosis». Curr. Top. Microbiol. Immunol. Current Topics in Microbiology and Immunology. 318: 325–42. ISBN 978-3-540-73676-9. PMID 18219824. doi:10.1007/978-3-540-73677-6_13
- ↑ a b c Kurtzke JF (outubro de 1993). «Epidemiologic evidence for multiple sclerosis as an infection». Clin. Microbiol. Rev. 6 (4): 382–427. PMC 358295
 . PMID 8269393
. PMID 8269393 - ↑ Gilden DH (março de 2005). «Infectious causes of multiple sclerosis». The Lancet Neurology. 4 (3): 195–202. PMID 15721830. doi:10.1016/S1474-4422(05)01017-3
- ↑ a b Chari DM (2007). «Remyelination in multiple sclerosis». Int. Rev. Neurobiol. International Review of Neurobiology. 79: 589–620. ISBN 978-0-12-373736-6. PMID 17531860. doi:10.1016/S0074-7742(07)79026-8
- ↑ Pittock SJ, Lucchinetti CF (março de 2007). «The pathology of MS: new insights and potential clinical applications». Neurologist. 13 (2): 45–56. PMID 17351524. doi:10.1097/01.nrl.0000253065.31662.37
- ↑ Iglesias A, Bauer J, Litzenburger T, Schubart A, Linington C (novembro de 2001). «T- and B-cell responses to myelin oligodendrocyte glycoprotein in experimental autoimmune encephalomyelitis and multiple sclerosis». Glia. 36 (2): 220–34. PMID 11596130. doi:10.1002/glia.1111
- ↑ «History of Blood-Brain Barrier». Consultado em 30 de janeiro de 2013. Arquivado do original em 25 de abril de 2012
- ↑ Trojano M, Paolicelli D (novembro de 2001). «The differential diagnosis of multiple sclerosis: classification and clinical features of relapsing and progressive neurological syndromes». Neurol. Sci. 22 (Suppl 2): S98–102. PMID 11794488. doi:10.1007/s100720100044[ligação inativa]
- ↑ Poser CM, Brinar VV (junho de 2004). «Diagnostic criteria for multiple sclerosis: an historical review». Clin Neurol Neurosurg. 106 (3): 147–58. PMID 15177763. doi:10.1016/j.clineuro.2004.02.004
- ↑ a b c d McDonald WI, Compston A, Edan G; et al. (julho de 2001). «Recommended diagnostic criteria for multiple sclerosis: guidelines from the International Panel on the diagnosis of multiple sclerosis». Ann. Neurol. 50 (1): 121–7. PMID 11456302. doi:10.1002/ana.1032
- ↑ Polman CH, Reingold SC, Edan G; et al. (dezembro de 2005). «Diagnostic criteria for multiple sclerosis: 2005 revisions to the "McDonald Criteria"». Ann. Neurol. 58 (6): 840–6. PMID 16283615. doi:10.1002/ana.20703
- ↑ Rashid W, Miller DH (fevereiro de 2008). «Recent advances in neuroimaging of multiple sclerosis». Semin Neurol. 28 (1): 46–55. PMID 18256986. doi:10.1055/s-2007-1019127
- ↑ Link H, Huang YM (novembro de 2006). «Oligoclonal bands in multiple sclerosis cerebrospinal fluid: an updata on methodology and clinical usefulness». J. Neuroimmunol. 180 (1–2): 17–28. PMID 16945427. doi:10.1016/j.jneuroim.2006.07.006
- ↑ Gronseth GS, Ashman EJ (maio de 2000). «Practice parameter: the usefulness of evoked potentials in identifying clinically silent lesions in patients with suspected multiple sclerosis (an evidence-based review): Report of the Quality Standards Subcommittee of the American Academy of Neurology». Neurology. 54 (9): 1720–5. PMID 10802774
- ↑ Pittock SJ, Rodriguez M (2008). «Benign multiple sclerosis: a distinct clinical entity with therapeutic implications». Curr. Top. Microbiol. Immunol. Current Topics in Microbiology and Immunology. 318: 1–17. ISBN 978-3-540-73676-9. PMID 18219812. doi:10.1007/978-3-540-73677-6_1
- ↑ a b Miller D, Barkhof F, Montalban X, Thompson A, Filippi M (maio de 2005). «Clinically isolated syndromes suggestive of multiple sclerosis, part I: natural history, pathogenesis, diagnosis, and prognosis». Lancet Neurol. 4 (5): 281–8. PMID 15847841. doi:10.1016/S1474-4422(05)70071-5
- ↑ Rovaris M, Confavreux C, Furlan R, Kappos L, Comi G, Filippi M (abril de 2006). «Secondary progressive multiple sclerosis: current knowledge and future challenges». Lancet Neurol. 5 (4): 343–54. PMID 16545751. doi:10.1016/S1474-4422(06)70410-0
- ↑ a b c Miller DH, Leary SM (outubro de 2007). «Primary-progressive multiple sclerosis». Lancet Neurol. 6 (10): 903–12. PMID 17884680. doi:10.1016/S1474-4422(07)70243-0
- ↑ Stadelmann C, Brück W (novembro de 2004). «Lessons from the neuropathology of atypical forms of multiple sclerosis». Neurol. Sci. 25 (Suppl 4): S319–22. PMID 15727225. doi:10.1007/s10072-004-0333-1
- ↑ The Royal College of Physicians (2004). Multiple Sclerosis. National clinical guideline for diagnosis and management in primary and secondary care. Salisbury, Wiltshire: Sarum ColourView Group. pp. 54–57. ISBN 1-86016-182-0
- ↑ Burton JM, O'Connor PW, Hohol M, Beyene J (2009). «Oral versus intravenous steroids for treatment of relapses in multiple sclerosis». Cochrane Database Syst Rev (3): CD006921. PMID 19588409. doi:10.1002/14651858.CD006921.pub2 Parâmetro desconhecido
|editor1-ultimo=ignorado (ajuda); Parâmetro desconhecido|editor1-primeiro=ignorado (ajuda) - ↑ a b c Comi G (outubro de 2009). «Treatment of multiple sclerosis: role of natalizumab». Neurol. Sci. 30. Suppl 2 (S2): S155–8. PMID 19882365. doi:10.1007/s10072-009-0147-2
- ↑ Johnson KP (2007). «Control of multiple sclerosis relapses with immunomodulating agents». J. Neurol. Sci. 256 (Suppl 1): S23–8. PMID 17350652. doi:10.1016/j.jns.2007.01.060
- ↑ Martinelli Boneschi F, Rovaris M, Capra R, Comi G (2005). «Mitoxantrone for multiple sclerosis». Cochrane database of systematic reviews (Online) (4): CD002127. PMID 16235298. doi:10.1002/14651858.CD002127.pub2 Parâmetro desconhecido
|editor1-nome=ignorado (ajuda); Parâmetro desconhecido|editor1-sobrenome=ignorado (ajuda) - ↑ Leary SM, Thompson AJ (2005). «Primary progressive multiple sclerosis: current and future treatment options». CNS Drugs. 19 (5): 369–76. PMID 15907149. doi:10.2165/00023210-200519050-00001
- ↑ Sládková T, Kostolanský F (2006). «The role of cytokines in the immune response to influenza A virus infection». Acta Virol. 50 (3): 151–62. PMID 17131933
- ↑ Munari L, Lovati R, Boiko A (2004). «Therapy with glatiramer acetate for multiple sclerosis». Cochrane database of systematic reviews (Online) (1): CD004678. PMID 14974077. doi:10.1002/14651858.CD004678Parâmetro desconhecido
|editor1-ultimo=ignorado (ajuda); Parâmetro desconhecido|editor1-primeiro=ignorado (ajuda) - ↑ Tremlett H, Oger J (novembro de 2004). «Hepatic injury, liver monitoring and the beta-interferons for multiple sclerosis». J. Neurol. 251 (11): 1297–303. PMID 15592724. doi:10.1007/s00415-004-0619-5
- ↑ Kesselring J, Beer S (2005). «Symptomatic therapy and neurorehabilitation in multiple sclerosis». The Lancet Neurology. 4 (10): 643–52. PMID 16168933. doi:10.1016/S1474-4422(05)70193-9
- ↑ Khan F, Turner-Stokes L, Ng L, Kilpatrick T (2007). «Multidisciplinary rehabilitation for adults with multiple sclerosis». Cochrane Database Syst Rev (2): CD006036. PMID 17443610. doi:10.1002/14651858.CD006036.pub2 Parâmetro desconhecido
|editor1-ultimo=ignorado (ajuda); Parâmetro desconhecido|editor1-primeiro=ignorado (ajuda) - ↑ Smith, Cath; Leigh Hale; Kärin Olson; Anthony Schneiders (2009). «How does exercise influence fatigue in people with multiple sclerosis?». Disability and Rehabilitation. 31 (9): 685–692. PMID 18841515. doi:10.1080/09638280802273473
- ↑ a b c O'Sullivan, Susan (2007). Physical Rehabilitation Fifth Edition. Philadelphia: F.A. Davis Company. pp. 136–146. ISBN 978- 0-8036-1247-1
- ↑ a b c Stroud NM, Minahan CL (2009). «The impact of regular physical activity on fatigue, depression and quality of life in persons with multiple sclerosis». Health and Quality of Life Outcomes. 7. 68 páginas. PMC 2717927
 . PMID 19619337. doi:10.1186/1477-7525-7-68
. PMID 19619337. doi:10.1186/1477-7525-7-68 - ↑ Rietberg MB, Brooks D, Uitdehaag BMJ, Kwakkel G (2005). «Exercise therapy for multiple sclerosis». Cochrane Database of Systematic Reviews. CD003980 (1): CD003980. PMID 15674920. doi:10.1002/14651858.CD003980.pub2 Parâmetro desconhecido
|editor1-ultimo=ignorado (ajuda); Parâmetro desconhecido|editor1-primeiro=ignorado (ajuda) - ↑ a b «Multiple sclerosis: its effects on you and those you love» (pdf). Multiple Sclerosis Society of Canada. 2008. Consultado em 11 de maio de 2011
- ↑ Dalgas U, Stenager E, Jakobsen J; et al. (2009). «Resistance training improves muscle strength and functional capacity in multiple sclerosis». Neurology. 73 (18): 1478–1484. PMID 19884575. doi:10.1212/WNL.0b013e3181bf98b4
- ↑ Davis, SL; Wilson, TE, White, AT, Frohman, EM (2010 Nov). «Thermoregulation in multiple sclerosis.». Journal of applied physiology (Bethesda, Md. : 1985). 109 (5): 1531–7. PMC 2980380
 . PMID 20671034. doi:10.1152/japplphysiol.00460.2010 Verifique data em:
. PMID 20671034. doi:10.1152/japplphysiol.00460.2010 Verifique data em: |data=(ajuda) - ↑ Olsen SA (2009). «A review of complementary and alternative medicine (CAM) by people with multiple sclerosis». Occup Ther Int. 16 (1): 57–70. PMID 19222053. doi:10.1002/oti.266
- ↑ Farinotti M, Simi S, Di Pietrantonj C; et al. (2007). «Dietary interventions for multiple sclerosis». Cochrane database of systematic reviews (Online) (1): CD004192. PMID 17253500. doi:10.1002/14651858.CD004192.pub2 Parâmetro desconhecido
|editor1-ultimo=ignorado (ajuda); Parâmetro desconhecido|editor1-primeiro=ignorado (ajuda) - ↑ Chong MS, Wolff K, Wise K, Tanton C, Winstock A, Silber E (2006). «Cannabis use in patients with multiple sclerosis». Mult. Scler. 12 (5): 646–51. PMID 17086912. doi:10.1177/1352458506070947
- ↑ Bennett M, Heard R (2004). «Hyperbaric oxygen therapy for multiple sclerosis». Cochrane database of systematic reviews (Online) (1): CD003057. PMID 14974004. doi:10.1002/14651858.CD003057.pub2 Parâmetro desconhecido
|editor1-ultimo=ignorado (ajuda); Parâmetro desconhecido|editor1-primeiro=ignorado (ajuda) - ↑ Adams, Tim (23 de maio de 2010). «Gut instinct: the miracle of the parasitic hookworm». The Observer
- ↑ a b c Phadke JG (maio de 1987). «Survival pattern and cause of death in patients with multiple sclerosis: results from an epidemiological survey in north east Scotland». J. Neurol. Neurosurg. Psychiatr. 50 (5): 523–31. PMC 1031962
 . PMID 3495637. doi:10.1136/jnnp.50.5.523
. PMID 3495637. doi:10.1136/jnnp.50.5.523 - ↑ Myhr KM, Riise T, Vedeler C; et al. (fevereiro de 2001). «Disability and prognosis in multiple sclerosis: demographic and clinical variables important for the ability to walk and awarding of disability pension». Mult. Scler. 7 (1): 59–65. PMID 11321195[ligação inativa]
- ↑ Menezes, Ana M. B. (2001). Silva, L.C.C., ed. Epidemiologia das doenças respiratórias (PDF). Rio de Janeiro: Revinter. pp. 10–11
- ↑ Fernandes, Rúben (2009). Faculdade de Medicina da Universidade de Coimbra, ed. Vivências de Pessoas com Esclerose Múltipla (PDF). Coimbra: [s.n.]
- ↑ Machado, Susana; et al. (2012). Recomendações Esclerose Múltipla (PDF). São Paulo: Ominfarma. ISBN 978-85-62477-13-3
- ↑ a b c Alonso A, Hernán MA (julho de 2008). «Temporal trends in the incidence of multiple sclerosis: a systematic review». Neurology. 71 (2): 129–35. PMID 18606967. doi:10.1212/01.wnl.0000316802.35974.34
- ↑ Pugliatti, M; Sotgiu, S, Rosati, G (Jul. 2002). «The worldwide prevalence of multiple sclerosis». Clinical neurology and neurosurgery. 104 (3): 182–91. PMID 12127652. doi:10.1016/S0303-8467(02)00036-7
- ↑ Kulie T, Groff A, Redmer J, Hounshell J, Schrager S (2009). «Vitamin D: an evidence-based review». J Am Board Fam Med. 22 (6): 698–706. PMID 19897699. doi:10.3122/jabfm.2009.06.090037
- ↑ a b Compston A (outubro de 1988). «The 150th anniversary of the first depiction of the lesions of multiple sclerosis». J. Neurol. Neurosurg. Psychiatr. 51 (10): 1249–52. PMC 1032909
 . PMID 3066846. doi:10.1136/jnnp.51.10.1249
. PMID 3066846. doi:10.1136/jnnp.51.10.1249 - ↑ Lassmann H (29 de outubro de 1999). «The pathology of multiple sclerosis and its evolution». Philos Trans R Soc Lond B Biol Sci. 354 (1390): 1635–40. PMC 1692680
 . PMID 10603616. doi:10.1098/rstb.1999.0508
. PMID 10603616. doi:10.1098/rstb.1999.0508 - ↑ Lassmann H (julho de 2005). «Multiple sclerosis pathology: evolution of pathogenetic concepts». Brain Pathology. 15 (3): 217–22. PMID 16196388. doi:10.1111/j.1750-3639.2005.tb00523.x
- ↑ a b Cohen JA (julho de 2009). «Emerging therapies for relapsing multiple sclerosis». Arch. Neurol. 66 (7): 821–8. PMID 19597083. doi:10.1001/archneurol.2009.104
- ↑ Kieseier BC, Calabresi PA (2012). «PEGylation of interferon-β-1a: a promising strategy in multiple sclerosis». CNS Drugs. 26 (3): 205-14. PMID 22201341. Consultado em 9 de janeiro de 2013. Arquivado do original em 1 de janeiro de 2013
- ↑ DeNoon, Daniel J. (2010). «FDA Panel Votes to Approve Gilenia, First Oral MS Drug». WebMD. Consultado em 13 de junho de 2010
- ↑ «Comunicado de imprensa da FDA sobre a aprovação de Gilenya»
- ↑ Kappos L; Radue, EW; O'Connor, P; Polman, C; Hohlfeld, R; Calabresi, P; Selmaj, K; Agoropoulou, C; Leyk, M (fevereiro de 2010). «A placebo-controlled trial of oral fingolimod in relapsing multiple sclerosis». N Eng J Med. 362 (5): 387–401. PMID 20089952. doi:10.1056/NEJMoa0909494
- ↑ Cohen JA; Barkhof, F; Comi, G; Hartung, HP; Khatri, BO; Montalban, X; Pelletier, J; Capra, R; Gallo, P (fevereiro de 2010). «Oral fingolimod or intramuscular interferon for relapsing multiple sclerosis». N Eng J Med. 362 (5): 402–415. PMID 20089954. doi:10.1056/NEJMoa0907839
- ↑ Patel PN (setembro de 2007). «Low-dose naltrexone for treatment of multiple sclerosis: clinical trials are needed». Ann Pharmacother. 41 (9): 1549–50. PMID 17623758. doi:10.1345/aph.1H083
- ↑ Gironi M, Martinelli-Boneschi F, Sacerdote P, Solaro C, Zaffaroni M, Cavarretta R, Moiola L, Bucello S, Radaelli M, Pilato V, Rodegher M, Cursi M, Franchi S, Martinelli V, Nemni R, Comi G, Martino G (2008). «A pilot trial of low-dose naltrexone in primary progressive multiple sclerosis». Multiple Sclerosis. 14 (8): 1076–83. PMID 18728058. doi:10.1177/1352458508095828
- ↑ a b c Harris VK, Sadiq SA (2009). «Disease biomarkers in multiple sclerosis: potential for use in therapeutic decision making». Mol Diagn Ther. 13 (4): 225–44. PMID 19712003. doi:10.2165/11313470-000000000-00000
- ↑ Qiu J (maio de 2010). «Venous abnormalities and multiple sclerosis: another breakthrough claim?». Lancet Neurol. 9(5): 464–5. PMID 20398855. doi:10.1016/S1474-4422(10)70098-3
- ↑ Ghezzi A, Comi G, Federico A (fevereiro de 2011). «Chronic cerebro-spinal venous insufficiency (CCSVI) and multiple sclerosis». Neurol. Sci. 32 (1): 17–21. PMID 21161309. doi:10.1007/s10072-010-0458-3
- ↑ Dorne H, Zaidat OO, Fiorella D, Hirsch J, Prestigiacomo C, Albuquerque F, Tarr RW. (outubro de 2010). «Chronic cerebrospinal venous insufficiency and the doubtful promise of an endovascular treatment for multiple sclerosis». J NeuroIntervent Surg. 2 (4): 309–311. doi:10.1136/jnis.2010.003947
- ↑ Khan O, Filippi M, Freedman MS, Barkhof F, Dore-Duffy P, Lassmann H, Trapp B, Bar-Or A, Zak I, Siegel MJ, Lisak R (12 de fevereiro de 2010). «Chronic cerebrospinal venous insufficiency and multiple sclerosis». Annals of Neurology. Annals of neurology. 67 (3): 286–90. PMID 20373339. doi:10.1002/ana.22001
- ↑ «Esclerose Múltipla - Introdução». Consultado em 23 de janeiro de 2013
- ↑ Planas, Raquel; Santos, Radleigh; Tomas-Ojer, Paula; Cruciani, Carolina; Lutterotti, Andreas; Faigle, Wolfgang; Schaeren-Wiemers, Nicole; Espejo, Carmen; Eixarch, Herena (10 de outubro de 2018). «GDP-l-fucose synthase is a CD4+ T cell–specific autoantigen in DRB3*02:02 patients with multiple sclerosis». Science Translational Medicine(em inglês). 10 (462): eaat4301. ISSN 1946-6234. doi:10.1126/scitranslmed.aat4301
- ↑ «Gut microbes could help trigger multiple sclerosis». Science | AAAS (em inglês). 11 de setembro de 2017
- ↑ «An elusive molecule that sparks multiple sclerosis may have been found». Science | AAAS (em inglês). 10 de outubro de 2018










Sem comentários:
Enviar um comentário