| Cancro colorretal |
|---|
|
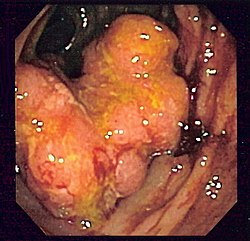
Ilustração do trato digestivo inferior |
| Especialidade | Oncologia |
| Sintomas | Sangramento gastrointestinal inferior, alteração nos movimentos intestinais, perda de peso, fadiga constante[1] |
| Causas | Idade avançada, estilo de vida, causas genéticas[2][3] |
| Fatores de risco | Dieta, obesidade, tabagismo, falta de exercício físico[2] |
| Método de diagnóstico | Biópsia durante uma sigmoidoscopia ou colonoscopia[1] |
| Prevenção | Rastreio entre os 50 e 75 anos[4] |
| Tratamento | Cirurgia, radioterapia, quimioterapia, terapia dirigida[5] |
| Prognóstico | Taxa de sobrevivência a 5 anos: 65% (EUA)[6] |
| Frequência | 9,4 milhões (2015)[7] |
| Mortes | 832 000 (2015)[8] |
| Classificação e recursos externos |
|---|
| CID-10 | C18-C20/C21 |
| CID-9 | 153.0-154.1 |
| ICD-O: | M8140/3 (95% cos casos) |
| OMIM | 114500 |
| DiseasesDB | 2975 |
| MedlinePlus | 000262 |
| eMedicine | med/413 med/1994 ped/3037 |
 Leia o aviso médico Leia o aviso médico |
O diagnóstico de cancro colorretal pode ser confirmado pela recolha e de uma
amostra do cólon através de
sigmoidoscopia ou
colonoscopia. Durante uma colonoscopia, geralmente são removidos os pequenos pólipos que forem encontrados. Quando é encontrado um pólipo grande ou um tumor, a biópsia permite confirmar se é canceroso.
[1] Posteriormente são realizados
exames imagiológicos para determinar se a doença
se espalhou.
[5] O rastreio é eficaz na prevenção e na diminuição da mortalidade por cancro colorretal.
[4] O rastreio de rotina é recomendado dos 50 até aos 75 anos de idade.
[4] A
aspirina e outros
anti-inflamatórios não esteroides diminuem o risco de cancro colorretal.
[2][10] No entanto, a sua utilização para este efeito não é recomendada devido aos efeitos adversos.
[11]
Os tratamentos para o cancro do cólon e do reto podem incluir alguma combinação de
cirurgia,
radioterapia,
quimioterapia e
terapia dirigida.
[5] Os cancros que se encontram restritos à parede do cólon podem ser curáveis com cirurgia. No entanto, os cancros que já se espalharam para outras partes do corpo geralmente não são curáveis, focando-se o tratamento na melhoria da qualidade de vida e alívio dos sintomas.
[5] A taxa de sobrevivência média a cinco anos nos Estados Unidos é de 65%.
[12] No entanto, a sobrevivência depende de quão avançada está a doença, se o cancro pode ou não ser removido com cirurgia e da condição geral de saúde da pessoa.
[1] Em todo o mundo, o cancro colorretal é o terceiro tipo mais comum de cancro, correspondendo a cerca de 10% de todos os casos.
[13] Em 2012 ocorreram 1,4 milhões de novos casos e 694 000 mortes pela doença.
[13] É mais comum em
países desenvolvidos, onde ocorrem 65% dos casos.
[2] É mais comum em homens do que em mulheres.
[2]
Os sintomas do cancro colorretal dependem da localização do tumor no intestino grosso, do tamanho do tumor em si, e se o tumor tem se
espalhado para outras partes do corpo. Os sintomas mais comuns do cancro colorretal são o sangramento intestinal, a mudança do hábito intestinal e da forma das fezes, a dor e distensão abdominais, emagrecimento e anemia. Como estes sintomas, bem como a maioria dos outros sintomas que podem estar presentes com o cancro, são sintomas de outras doenças (como no caso da
hemorroida e da
doença diverticular), nenhum dos sintomas presentados a seguir são específicos de cancro colorretal, e todos devem procurar auxílio médico para fazer um diagnóstico correto dos sintomas.
Sintomas podem ser locais (presentes na região afetada pelo tumor primário), gerais (afetando o corpo inteiro), ou metastáticos (causados por metástases).
Sintomas locais dependem da localização do tumor primário no intestino grosso, sendo mais comuns se o tumor estiver localizado mais próximo ao
ânus. Sintomas incluem
dor, mudança de hábitos intestinais (tal como
diarreia ou
obstipação na ausência de outros possíveis agentes causadores), sensação de defecação incompleta, e mudanças no tamanho e formato das fezes (por exemplo, o diâmetro das fezes pode ser menor que o habitual).
Cancros no cólon ascendente e no cecum tendem a crescer de maneira exofítica, ou seja, da
parede intestinal para o exterior do intestino grosso. Por causa disso, tais tumores raramente causam obstrução intestinal, com
anemia sendo um sintoma muito mais comum. Por outro lado, cancros no lado esquerdo do sistema colorretal tendem a crescer de maneira circular, envolvendo o intestino, e facilmente causando obstrução intestinal.
Hemorragia é um sintoma comum. Presença de sangue nas fezes é um possível indicativo de tumor no sistema digestivo. Se o tumor está presente no reto, um possível sintoma é desconforto na região retal. Se o tumor está localizado no reto ou no cólon descendente, sangue (de cor vermelha clara) e um crescimento da presença de
muco nas fezes.
Melena, ou seja, fezes de cor escura e cheiro fétido, pode estar presente se o tumor está localizado no cólon transverso ou ascendente.
Certos sintomas do cancro colorretal aparecem quando a doença avança em severidade. Um tumor grande pode ser mais facilmente notado no abdômen, podendo ser notado em um
exame físico (por exemplo,
palpação). Com o crescimento do tumor, presença de ar ou sangue na
urina é possível (quando o tumor invade a
bexiga), bem como secreções abnormais na
vagina, no caso de invasão do
aparelho reprodutor feminino.
O órgão mais afetado por metástases do cancro colorretal é o
fígado. Este é geralmente afetado em estádio avançado do cancro pelo fato de que a circulação venosa do intestino grosso é feita pela
veia porta hepática, e passa pelo fígado. Sintomas de metástases no fígado muitas vezes não causam sintomas notáveis.
[14] Grandes depósitos metastáticos no fígado podem causar
icterícia, dor abdominal (devido ao esticamento das
cápsulas fibrosas de Glisson. Se a metástase bloqueia o
ducto biliar, a icterícia pode ser acompanhada por outros sintomas de
obstrução biliar, tal como
esteatorreia (fezes de cor clara).

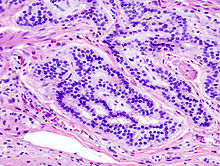
Lâmina histológica de um adenoma tubular, um tipo de pólipo colonial, e um precursor do cancro colorretal.
Certos fatores aumentam as chances de uma pessoa ter a doença.
[15] Estes fatores incluem:
- Idade: O risco de uma pessoa ter cancro colorretal aumenta com a idade. Ter 50 anos ou mais de idade é um fator em risco em si. Casos antes dos 50 anos são raros, mas podem ocorrer, especialmente se um histórico familiar de desenvolvimento do cancro antes dos 50 existe.[16]
- Hereditariedade:
- Histórico familiar de cancro colorretal: presença de um ou mais parentes de sangue com cancro colorretal, especialmente se o parente é próximo e desenvolveu a doença antes dos 55 anos de idade, ou se múltiplos parentes adquiriram a doença.[17] Cerca de 6% dos cancros colorretais são causados especificamente por problemas genéticos.
- Polipose adenomatosa familiar (FAP): se uma pessoa possui FAP, a chance dele possuir cancro colorretal antes dos 40 anos de idade (se não tratada através de cirurgia) é de quase 100%. Responsável por cerca de 1% dos casos do cancro colorretal.
- cancro colorretal hereditário sem polipose: forma de cancro hereditário, causada por mutações em genes de reparo de DNA. Cerca de 5% dos casos de cancro colorretal podem ser atribuídos a tais mutações.
- A presença de pólipos no intestino grosso é um fator de risco, especialmente se são de natureza adenomatosa. Remover os pólipos presentes no intestino grosso diminui subsequentemente o risco de cancro colorretal.
- Histórico de cancro: indivíduos que já tiveram cancro colorrectal anteriormente estão com risco de desenvolver a doença novamente no futuro. Mulheres que tiveram cancro de ovário, útero ou mama também possuem uma chance maior de ter cancro colorretal.
- Dieta: presentemente, o impacto que a dieta alimentar possui como um fator de risco do cancro colorretal é controverso. Estudos mostram que uma dieta rica em carne vermelha[18] e baixo em frutas frescas, vegetais e legumes, peixes e aves de capoeira aumentam as chances de cancro colorretal. Um estudo da European Prospective Investigation into Cancer and Nutrition, de junho de 2005, sugeriu que dietas ricas em carne vermelha e carnes processadas e baixo em fibra alimentar são associados com maior chance de cancro colorretal. Indivíduos qu comem frequentemente carne de peixe possuem um risco mais baixo.[19] Porém, outros estudos colocam em dúvida sobre o fato que uma dieta baixa em fibras aumente o risco de cancro colorretal, argumentando que tais dietas estão associadas a outros fatores de risco, resultando em erros no estudo.
- Fumo: As pessoas que fumam possuem um risco maior de morrer por causa da doença do que pessoas que não fumam. Um estudo da American Cancer Society concluiu que "mulheres que fumam possuem 40% de chance a mais, do que mulheres que não fumam, de morrer por causa de cancro colorretal, enquanto que o aumento entre homens que fumam é de 30% em relação a homens que nunca fumaram.[20][21]
- Sedentarismo: indivíduos que são fisicamente inativos possuem um risco maior de ter cancro colorretal do que pessoas fisicamente ativas.
- Vírus: alguns vírus (tal como certos tipos do vírus do papiloma humano podem estar associados ao cancro colorretal.
- Colite ulcerosa e Colangite esclerosante primária aumentam o risco de cancro colorretal; o risco do último é independente do primeiro (visto que ambas possuem uma associação significativa).
- Níveis baixos de selênio.[22][23]
- Doença inflamatória intestinal.[24][25] Cerca de 1% dos pacientes com cancro colorretal possuem história de colite ulcerativa crônica. O risco de ter cancro colorretal varia de acordo com a idade em que a colite aparece, diretamente com a extensão de envolvimento no cólon, e a duração da doença em si. Pacientes com doença de Crohn possui um risco um pouco maior de terem cancro colorretal, mas que é menos do que pacientes com colite ulcerativa.[26]
- Fatores ambientais:[24] Habitantes de países industrializados possuem um risco maior de adquirir cancro colorretal do que habitantes de países menos industrializados, nos quais dietas ricas em fibra alimentar e baixo em gordura são mais prevalentes. Estudos de migrações populacionais revelam o impacto que fatores ambientais, especialmente de natureza dietária, possuem na etiologia do cancro colorretal.
- Hormônios exógenos: diferenças em estudos longitudinais entre homens e mulheres e cancro colorretal podem ser explicados por efeitos de coorte em relação à exposição para algum fator de risco (associado especificamente com o sexo). Uma possibilidade é exposição para estrogênios.[27] Isto é válido primariamente para estrogênios exógenos, não produzidos naturalmente pelo corpo, tais como terapia hormonal. Em contrapartida, há pouca evidência que isto é válido para estrogênios endógenos, ou seja, produzidos naturalmente pelo corpo.[28]
- Álcool: possivelmente um fator de risco.[29]
O NIAAA diz que: "Estudos epidemiológicos acharam uma pequena mas consistente associação entre o consumo de álcool (relacionado à quantidade de doses consumidas) e cancro colorretal,
[30][31] mesmo quando fatores dietários tais como fibras estão sob controle
[32][33] Despite the large number of studies, however, causality cannot be determined from the available data."
[29]
Um estudo concluiu que indivíduos que tomam mais de 30 gramas de álcool por dia, e especialmente mais de 45 gramas por dia, possuem uma chance maior de adquirir cancro colorretal".
[34][35] Outro concluiu que o consumo diário de bebidas alcoólicas está relacionado com um aumento de 70% na probabilidade de adquirir cancro de cólon
[36][37][38]
Outro estudo concluiu que o risco de cancro colorretal é duas vezes maior em indivíduos que consomem constantemente
cervejas e
espíritos, embora seja menor em pessoas que tomam
vinho.
[39]
Outros estudos sugerem que moderação é um modo de minimizar o risco de adquirir cancro colorretal,
[29] e que o consumo de bebidas alcoólicas podem causar precipitar o desenvolvimento mais cedo de cancro colorretal.
[40]
O
Instituto de cancro Nacional americano não lista álcool como um fator de risco,
[41] porém, em outra página, sugere que o "consumo frequente de bebidas alcoólicas pode aumentar o risco de cancro colorretal"
[42]
Em 85% dos casos, o cancro colorretal é precedido por uma lesão benigna conhecida por
pólipo. Dependendo da característica deste pólipo, ele pode se tornar maligno e iniciar o cancro. Devido a este processo é que se faz a prevenção deste tipo de tumor com a colonoscopia, já que este exame permite o diagnóstico e a retirada do pólipo. Nos outros 15% dos casos, o tumor ocorre devido a uma doença genética, e se caracteriza por acometer pacientes mais jovens e por não apresentar o pólipo como lesão pré-maligna, ou seja, surge diretamente na parede do intestino.
Em aproximadamente 25% dos casos de cancro colorretal, o tumor está presente no reto, e 24%, no cólon sigmóide, ou seja, em metade dos casos, o tumor está localizado na região retosigmóide do intestino grosso, e pode ser visualizado por um
sigmoidoscópio. Em outros 20% dos casos, o tumor pode ser detectado através de um
exame retal. Em outras partes do cólon, as taxas são cerca de 6% no cólon descendente, 11% no cólon transverso, 24% no cólon ascendente, e 10% no
cecum.
O cancro colorretal pode tomar muitos anos para desenvolver-se, e detecção do cancro nos estádios iniciais aumenta significantemente as chances de cura. O
National Cancer Policy Board do
Instituto de Medicina americano, estimou em 2003 que até modestos esforços para implementar métodos de detecção do cancro colorretal causaria uma queda de 29% em mortes de cancro em 20 anos. Porém, a taxa de indivíduos utilizando métodos de detecção precoce permanecem baixas.
[45]
Vários tipos de testes podem ser utilizados para detecção do cancro colorretal:
- Exame retal: o médico, utilizando luvas e lubrificante, coloca o dedo dentro do reto do paciente, buscando por áreas anormais. Este teste não deve ser utilizado como método único de detecção - uma vez que somente cerca de 20% dos tumores colorretais estão ao alcance do dedo, e somente tumores grandes o suficiente podem ser sentidos através desta técnica - mas pode ser utilizado como um método inicial de detecção, sempre em conjunto com outros métodos.
- Exame de sangue oculto nas fezes: teste que verifica a presença de sangue nas fezes. Dois tipos de testes podem ser utilizados para detectar sangue oculto nas fezes: químico ou imunoquímico. A sensitividade do teste imunoquímico é superior ao teste químico, sem causar uma redução inaceitável em especificidade.[46]
- Endoscopia:
- Sigmoidoscopia: uma sonda iluminada (o sigmoidoscópio) é inserida no reto e no cólon inferior, para detectar pólipos e outras abnormalidades.
- Colonoscopia: Uma sonda iluminada (o colonoscópio) é inserida no reto e em todo o cólon, para detectar pólipos e outras abnormalidades. Vantagens em relação à sigmoidoscopia é que se pólipos são encontrados, eles podem ser removidos, tecido pode ser removido (biópsia), além de abranger todo o cólon, e não somente a parte inferior.
- Enema de bário com duplo contraste: com o cólon livre de material fecal, um enema contendo sulfato de bário é administrado, e então ar é inserido dentro do cólon, distendendo-no. O resultado é uma faixa fina de bário cobrindo todo o interior do cólon, que é visível em raios-X. Tumores ou pólipos podem ser detectados através deste método. Esta técnica pode não detectar pólipos planos (não muito comuns).
- Colonoscopia virtual substitui filmes de raios-X no enema de bário com duplo contraste (acima) com um exame especial de tomografia computadorizada, que requer software apropriado para permitir a interpretação por um radiologista. Esta técnica está alcançando a colonoscopia em sensitividade na detecção de pólipos. Porém, quaisquer pólipos que são encontrados ainda precisam ser removidos via uma colonoscopia padrão.
- Tomografia computadorizada axial é um método que utiliza raios-X que pode ser utilizado para determinar o grau de espalhamento do cancro, mas não é sensitivo o suficiente para ser utilizado como método de detecção precoce. Certos tipos de cancro são encontrados em exames tomográficos realizados por outras razões.
- Exames de sangue: o nível de certas proteínas no sangue pode ser um indicativo da severidade do tumor - em especial, antígene carcinoembriônico. Porém, um resultado negativo não significa necessariamente ausência de malignidade, e um resultado positivo (sujeitos, portanto a falsos positivos e falsos negativos), cancro colorretal especificamente, e portanto, não devem ser utilizados como método de detecção precoce. Altos níveis do antígene carcinoembriônico podem significar metástases ou outros tipos de cancro. Porém, tais exames podem ser ser usados para monitorizar o paciente após cirurgia ou outro tratamento.
- Aconselhamento genético e exame genético podem ser utilizados em famílias que possuem uma forma hereditária do cancro colorretal, tal como cancro colorretal hereditário sem polipose, ou polipose familiar adenomatoso.
- Tomografia por emissão de positrões (PET) é uma técnica no qual um açúcar radioativo é injetado no paciente; tal açúcar acumula-se em tecidos com alta atividade metabólica (incluindo células cancerosas), a radiação emitida pelo açúcar permite a formação de uma imagem. Por causa do fato que células cancerígenas possuem um alto metabolismo, esta técnica pode ser utilizada para diferenciar tumores benignos e malignos. Porém, esta técnica não é utilizada como método de detecção precoce. Um exame de PET do corpo inteiro é considerado o método mais preciso de cancro colorretal recorrente, e é uma maneira custo-efetiva de diferenciar tumores que podem ser cirurgicamente removidos dos que não podem. Este exame é indicado quando uma decisão depende de um preciso estudo da presença do tumor e da sua extensão.
- Exame de DNA nas fezes é uma tecnologia emergente utilizado para detectar cancro colorretal. Adenomas pré-malignos e células cancerígenas liberam marcadores de DNA que não são decompostos no processo digestivo, e permanecem intactos nas fezes. PCR aumenta a concentração de DNA para níveis detectáveis. Ensaios clínicos têm mostrado uma sensitividade de detecção de cancro de 71% a 91%.[47]

Adenocarcinoma invasivo (o tipo mais comum de cancro colorretal). Células cancerosas estão no centro e à esquerda inferior da imagem (em azul).
O tipo do tumor é geralmente diagnosticado através da análise de tecido removido através de uma
biópsia ou
cirurgia. O diagnóstico patológico geralmente contém a descrição
histológica do cancro, e o grau. O tipo mais comum de cancro colorretal é
adenocarcinoma, que compõe 95% dos casos - acredita-se que a maioria dos casos de cancro colorretal envolvam tumores originários de pólipos adematosos. Outros tipos, mais raros, de cancro colorretal, incluem
linfoma e
carcinoma espinocelular. As causas do cancro colorretal não são conhecidas com exatidão no presente.
Adenocarcinoma é um tipo de tumor maligno epitelial, que se origina do epitélio glandular da mucosa colorretal. Tal tumor invade a parede, infiltrando a
mucosa muscular, a
submucosa, e daí, a
muscularis propria. As células do tumor abrigam estruturas tubulares irregulares, de estrutura pluristratificada, lúmens múltiplos, e
estromas reduzidos. Por vezes, as células do tumor secretam muco, que invade o
fluido intersticial, produzindo grandes agrupamentos de muco e colóide (que, visualmente, aparecem como "espaços vazios") - é o chamado adenocarcinoma colóide, pouco diferenciado. Se o muco permanece dentro da célula do tumor, o muco empurra o
núcleo celular para a periferia da célula - célula do tipo
signet-ring. Dependendo da arquitetura glaudular,
pleomorfismo celular, e padrão da secreção de muco, o adenocarcinoma pode ser categorizado em três graus de diferenciação: bem diferenciado, moderadamente diferenciado, e mal diferenciado.
[48]
Acredita-se que a maioria dos tumores do cancro colorretal sejam positivos a
COX-2. Esta
enzima geralmente não é encontrada em tecido saudável do cólon. Acredita-se que tal enzima alimenta crescimento celular anormal.
| Estádio (AJCC) | Estádio (TNM) | Critério TNM de cancro colorretal[49] |
|---|
| Estádio 0 | Tis N0 M0 | Tis: Tumor confinado na mucosa; ou seja, carcinoma in situ |
| Estádio I | T1 N0 M0 | T1: Tumor invade a submucosa |
| Estádio I | T2 N0 M0 | T2: Tumor invade a muscularis propria |
| Estádio II-A | T3 N0 M0 | T3: Tumor invade a subserosa, ou além (sem envolver outros órgãos) |
| Estádio II-B | T4 N0 M0 | T4: Tumor invade órgãos adjacentes, ou perfura o peritôneo |
| Estádio III-A | T1-2 N1 M0 | N1: Metástase para um a três nódulos linfáticos. T1 ou T2. |
| Estádio III-B | T3-4 N1 M0 | N1: Metástase para um a três nódulos linfáticos. T3 ou T4. |
| Estádio III-C | qualquer T, N2 M0 | N2: Metástases para quatro ou mais nódulos regionais. Qualquer T. |
| Estádio IV | qualquer T, qualquer N, M1 | M1: Metástases distantes presentes. Qualquer T, qualquer N. |
O
estadiamento de cancro colorretal é uma estimativa da extensão de penetração de um cancro em particular. É feito por razões de diagnose e pesquisa, e para determinar o melhor método de tratamento. Os sistemas para avaliar cancros colorretais dependem da extensão da invasão local, o degrau de invasão de nódulos linfáticos, e da presença de
metástases distantes.
Estadiamento definitivo pode ser somente feito após
colectomia. Uma exceção para este princípio seria após uma polictomia colonoscópica de um pólipo pdunculado maligno, com mínima invasão. Estadiamento pré-operacional de cancros do reto pode ser feito com
ultra-som endoscópico. Estadiamento adjunto de metástases inclui
ultrassom abdominal,
CT,
PET, e outros estudos de imagem.
O sistema de estadiamento mais comum é a
classificação TNM (para tumores, nódulos e metástases), desenvolvida pela
American Joint Committee on Cancer (AJCC). O sistema TNM possui três categorias, cada uma com números indicando a severidade da extensão do tumor. "T" denota o degrau de invasão da parede intestinal, "N" o degrau de involvimento de nódulos linfáticos, e "M" a presença de
metástases. Estádios são geralmente descritos em numerais romanos (I, II, III, IV). Um número maior indica cancro mais avançado, e pior prognóstico.
- A: Tumor confinado na mucosa da parede intestinal.
- B1: Tumor expandindo-se dentro da mucosa, mas não além.
- B2: Tumor expande-se para outras regiões da parede intestinal, mas não além.
- C1: Tumor invade nódulos linfáticos, nódulo linfático ápico não invadido.
- C2: Tumor invade nódulos linfáticos, nódulo linfático ápico invadido.
- D: Presença de metástases distantes.
Alguns centros de tratamento de cancro ainda utilizam este sistema.
Acredita-se que a maioria dos cancros colorretais podem ser prevenidos, através do uso de métodos de deteção, da manutenção de um saudável estilo de vida, e provavelmente, do uso de agentes dietários quimiopreventivos.
A maioria dos tumores colorretais surgem de pólipos adenomatosos. Tais pólipos podem ser detectados e removidos através de
colonospia. Este método é considerado presentamente o
padrão-ouro de detecção do cancro colorretal.
Estudos mostram que o uso frequente deste procedimento médico poderia diminuir em 80% o número de mortes causados pelo cancro, desde que tais testes comecem na idade de 50 anos, e repetidos a cada cinco a dez anos.
[50]
Para indivíduos sem sintomas, sem fatores de risco, mas com 50 anos de idade ou mais, um exame de
sangue oculto nas fezes ou
contraste duplo de enema de bário anual, e
sigmoidoscopia cada cinco anos, a partir dos 50 anos, podem ser utilizados em conjunto ao invés de colonoscopia, como método de detecção. Sigmoidoscopia mais contraste duplo em conjunto é utilizado também quando acredita-se que um indivídui possa ter cancro colorretal, e abnormalidades embora o padrão-ouro de detecção seja colonoscopia, que, se não utilizado como o principal método de detecção do cancro colorretal, é utilizado se abnormalidades são encontradas nos exames acima.
A análise da incidência do cancro colorretal em vários países sugere que
sedentarismo, comer em excesso (por exemplo, dieta alta em calorias), e possivelmente, uma dieta rica em carne vermelha ou processada pode aumentar o risco de cancro colorretal. Em contraste, um peso dentro de padrões considerado saudáveis, atividade física, e uma dieta saudável, diminui o risco de cancro, em geral. Mudanças no estilo de vida podem diminuir o risco de cancro colorretal em 60% a 80%.
[51]
Até recentemente, acreditava-se que uma dieta rica em fibra alimentar (frutas, cereais, vegetais) reduzisse o risco de cancro colorretal e adenoma. O maior estudo já realizado para examinar esta teoria (envolvendo 88 757 participantes ao longo de 16 anos), porém, demonstrou que uma dieta rica em fibra alimentar não reduz o risco de cancro colorretal.
[52] Uma metanálise suporta esta conclusão.
[53]
Acredita-se que cerca de 200 agentes, incluindo aspirina e componentes nutricionais tais como
cálcio e
ácido fólico, podem diminuir carcninogênese, segundo modelos de
desenvolvimento pré-clínico. Alguns estudos mostram inibição de tumores induzidos por carcinógenos no cólon de
ratos. Outros estudos mostram uma forte inibição no pólipos intestinais de ratos (geneticamente criados para terem tais pólipos). Ensaios clínicos em humanos mostram um efeito reduzido, mas poucos estudos de intervenção envolvendo tais agentes foram realizados presentemente.
[54]
Uma metanálise concluiu que a ingestão diária de 300 mg ou mais durante cinco anos é efetivo na prevenção do cancro colorretal em
provas controladas aleatórias, com uma latência de cerca de dez anos.
[55] Porém, aspirina não deve ser tomada routineiramente com o intuito de prevenir cancro colorretal, mesmo em pessoas com histórico familiar, por causa do risco de
hemorragia e
insuficiência renal se uma alta dose de aspirina é ingerida constantemente (300 mg ou mais, com maior risco de hemorragia se mais de 81 mg o dia de aspirina é ingerido
[56]), com potenciais problemas à saúde de maior peso do que o possível benefício.
[57] Uma recomendação de prática clínica da
U.S. Preventive Services Task Force (USPSTF) é contra o uso da aspirina, argumentando que embora a aspirina possa diminuir o risco de ter cancro do cólon, que os "riscos são maiores que benefícios".
Uma metanálise da
Colaboração Cochrane de 2002 concluiu que, embora haja evidência que suplementos de cálcio podem prevenir moderadament pólipos colorretais adenomatosos, tal evidência não é suficiente para recomendar o uso geral de suplementos de cálcio com o intuito de prevenir cancro colorretal.
[58] Subsequentemente, uma prova controlada aleatória da
Women's Health Initiative obteve resultados negativos.
[59] Uma outra prova controlada aleatória anunciou redução em todos os tipos de cancros, mas tinha um número insuficiente de casos envolvendo cancro colorretal para análise.
[60]
O tratamento depende do estagiamento do cancro. O índice de cura de cancro diagnosticado nos estádios iniciais é significantemente maior do que quando detectado em estádio avançado (quando
metástases distantes estão presentes).
Cirurgia é atualmente o principal método de tratamento curativo do cancro colorretal, enquanto que
quimioterapia e/ou
radioterapia podem ser recomendados, dependendo do estagiamento do cancro e de outros fatores médicos.
Tratamento agressivo de cancro colorretal é muitas vezes um desafio (especialmente após cirurgia), uma vez que a maioria dos pacientes afetados são pessoas mais velhas. Estudos sugerem que tratamento em idosos em boas condições físicas é mais bem-sucedido se quimioterapia adjuvante é utilizado após cirurgia. Por causa disso, idade cronológica não deve ser uma contraindicação para tratamento agressivo, por si só.
[61]
Antígeno carcinoembriônico é uma
proteína presente no sangue em virtualmente todos os tumores colorretais (bem como outros tipos de cancros). A análise dos níveis desta proteína com o tempo, pré e pós-cirurgia, permite monitorar o tratamento do cancro. Altos níveis desta proteína, ou a ausência de uma queda notável no nível desta proteína, pós-cirurgia, são um indicativo de tumor residual ou metástases. Diminuição do nível do antígeno é um indicativo de que o tumor foi removido com relativo sucesso. Um aumento nos níveis do antígeno pós-cirurgia é indicativo de recorrência.

Microfoto de uma metástase colorretal em um
nódulo linfático. As células cancerosas estão no topo esquerdo e no centro da imagem.
As chances do tratamento ser eficiente dependem do estádio do cancro. No geral, 90% dos pacientes que são diagnosticados com cancro em estádios iniciais sobrevivem cinco anos, caindo para 64% se o tumor invadiu nódulos linfáticos e/ou órgãos próximos.
[14] Quando o cancro é diagnosticado em estádio avançado, com metástases distantes, a taxa de sobrevivência de cinco anos é de 20%.
Presentemente, cirurgia é o único tratamento curativo usado no tratamento do cancro colorretal.
Cirurgias podem ser categorizadas em curativo, paliativo, ou de bypass.
Em cirurgias de caráter curativo, a parte afetada do órgão é removida.
Anastomose pode ou não ser possível, dependendo da severidade e da localização do tumor. Se anastomose não é possível, a porção distal do aparelho colorretal é removida.
Cirurgias de caráter curativo são oferecidos quando:
- cancro em estádios bem iniciais que se desenvolvem dentro de um pólipo podem ser tratados com a remoção do pólipo (através de uma polictemia) em uma colonoscopia.
- Um tumor mais avançado tipicamente requer a remoção cirúrgica da secção afetada pelo tumor, bem como tecido aparentemente saudável em torno do tumor (margem de segurança), além da amputação radical do mesentério e nódulos linfáticos locais, para reduzir recorrência local. Se possível, as partes restantes do cólon são ligadas através de uma anastomose, para criar um cólon funcional. Se anamostose não é possível, toda a parte afetada do cólon, bem como a região distal do aparelho colorretal, é removida, e uma ostomia (um orifício artificial) é criada, via colostomia. Ou seja, mais cólon é removido à medida que a região afetada é mais próxima ao intestino delgado. Por vezes, a região saudável distal do cólon é mantida e suturada (Cirurgia de Hartmann), quando a parte afetada está localizada na região reto-sigmóide do cólon; neste caso, futura anastomose por emissão de positrões é possível.[14]
- Cirurgia de caráter curativo no cancro retal inclui ou amputação parcial da parte anterior inferior do reto, ou uma amputação abdominoperineal. Dependendo da severidade do cancro, os médicos podem optar por remover apenas a parte afetada, em uma amputação parcial. o restante do reto pode ser conectado com o restante do cólon via anastomose. Se o restante saudável do reto não é suficiente para garantir uma anastomose segura e/ou funcionamento do esfincter anal, ou se o tumor está próximo ao ânus (dois a cinco centímetros), amputação parcial do reto não é possível, e todo o reto mais a região proximal do cólon sigmóide é amputado via amputação abdominoperineal, e uma colostomia de caráter permanente é realizada.
Se metástases existem, cirurgia de caráter curativo não é uma opção (por ser considerado fútil), no geral. Porém, cirurgia de caráter paliativo pode ser realizada, com o intuito de deixar o paciente mais confortável: a remoção de parte ou todo tumor primário tem o intuito de reduzir a morbidade causada por hemorragia (causado pelo tumor), invasão, e seu efeito catabólico. Porém, no caso de metástases isoladas no
fígado, cirurgias de caráter curativo pode ainda ser realizadas, sendo relativamente comuns. Avanços na quimioterapia têm aumentado o número de pacientes que recebem a opção de remover cirurgicamente metástases isoladas no fígado.
Se o tumor invadiu estruturas vitais (tornando excisão cirúrgica tecnicamente difícil), cirurgiões podem optar por não remover o tumor, e ao invés disso, criar uma nova passagem para a passagem de fezes, e removendo a parte afetada da parte do restante do sistema digestivo do paciente (mas não removendo tal parte), em uma cirurgia de
bypass; ou através de uma diversão fecal (
colostomia). O intuito de ambos os tipos de cirurgia é comumente paliativo, embora cirurgia de caráter curativo possa ser realizada caso o tumor responda a quimioterapia.
Um último tipo de cirurgia é o "abre-e-fecha", de caráter não-intencional: tal cirurgia acontece quando os cirurgiões descobrem que o tumor não pode ser removido, e quando o
intestino delgado foi invadido pelo tumor; neste caso, a continuação da cirurgia causará mais problemas do que benefícios para o paciente. Este tipo de cirurgia é cada vez mais incomum devido à
laparoscopia e avanços radiológicos. Casos anteriormente vulneráveis ao "abre-e-fecha" atualmente são frequentemente diagnosticados em avanço, e cirurgia é evitada.
Coloctemia assistida por
laparoscopia é um procedimento pouco invasivo que pode reduzir o tamanho da incisão e dor pós-operacional.
Como qualquer procedimento cirúrgico, cirurgia coloretal pode resultar em complicações, tais como:
- Infecção nas regiões diretamente afetadas pela cirurgia.
- Hérnia intestinal, e/ou deincência.
- Hemorragia, com ou sem formação de hematoma.
- Quebra da anastomose, levando a abscesso, formação de fístula, e/ou peritonite.
- Adesões, resultando em obstrução intestinal. Em um estudo de cinco anos, com pacientes que tiveram cirurgia em 1997, 15% dos pacientes foram readmitidos após panproctocolectemia, 9% após colectemia total, e 11% após ileostomia.[62]
- Lesões a órgãos adjacentes, mais comumente, para o intestino delgado, uretras, baço e/ou bexiga.
- Complicações cardio-respiratórias, tais como infarto do miocárdio, pneumonia, arritmias, embolismo pulmonar, etc.
Quimioterapia é utilizada para reduzir o risco de metástases, para reduzir o tamanho do tumor, e/ou reduzir o crescimento do tumor. Quimioterapia é comumente utilizada após cirurgia, como método de tratamento adjuvante, antes de cirurgia, como método de tratamento neo-adjuvante, ou como o principal método de tratamento, em paliação. O uso de tratamentos mostrados aqui tem resultado, em
ensaios clínicos, em uma diminuição da taxa de mortalidade, e como resultado, esses tratamentos foram aprovados para uso pela
FDA (nos Estados Unidos). Em geral, quimioterapia é somente utilizada após cirurgia se o tumor espalhou-se para nódulos linfáticos (estádio III).
Em 2008, pesquisadores anunciaram, em um encontro anual da
American Society of Clinical Oncology (ASCO, Sociedade de Clínica Oncológica Americana), que pacientes com cancro colorretal que possuem uma mutação no
gene KRAS não respondem a certas drogas quimioterapêuticas, mais especificamente, àquelas que inibem o receptores de fator de crescimento epidermal nas células cancerosas (
EGFR, de
epidermal growth factor receptor) - tais como Erbitux (cetuximab) e Vectibix (panitumumab).
[63] Após recomendações da ASCO, pacientes devem agora ser testado pela mutação no gene KRAS (nos Estados Unidos), antes de puderem utilizar tais drogas inibidoras do EGFR.
[64] Em 2009, a FDA nos Estados Unidos obrigou que as embalagens de duas drogas antiEGFR anticorpo monoclonal (
panitumumab e
cetuximab), indicados para o tratamento de cancro metastático colorretal, para incluir informação sobre tais mutações do KRAS.
[65]
Porém, mesmo que o gene KRAS seja normal, não há nenhuma garantia que tais drogas irão beneficiar o paciente.
[63] Nestes pacientes, drogas antiEGFR reduzem o tamanho dos tumores em cerca de 40% dos pacientes. Estudos mostram que cerca de 35% a 46% dos pacientes possuem mutações no gene KRAS. O custo-benefício de testar pacientes para verificar por mutações no gene KRAS, poderia salvar cerca de 740 a 750 milhões de dólares (nos Estados Unidos) para pacientes, que não iriam beneficiar das drogas.
[66]
- Quimioterapia como tratamento adjuvante (após cirurgia): um regime comumente usado envolve a combinação das três seguintes drogas:
- Quimioterapia em cancros metastáticos: regimes comumente usados envolvem a combinação de 5-fluorouracil, leucovorina e oxaliplatina com bevacizumab; ou 5-fluorouracil, leucovorina e irinotecan com bevacizumab.
- Em ensaios clínicos para cancro colorretal avançado (metástases distantes):
Radioterapia não é utilizada frequentemente no tratamento do cancro colorretal, porque pode causar
enterite radioativa, bem pelo fato de que mirar partes específicas do cólon é difícil (por causa de
peristalse). Radioterapia é mais utilizada em cancro do reto, já que o reto não se movimenta tanto como o cólon, e por isso, é mais fácil de mirar. Às vezes, agentes quimioterapêuticos são utilizados para aumentar a eficiência da radiação, através do aumento da sensitividade em células do tumor, se presentes. Indicações para o uso de radioterapia incluem:
- Paliação e redução de dor em cancro do cólon avançado. Neste caso, não utilizado no tumor primário, mas sim em depósitos de metástases, se eles comprimem estruturas vitais e/ou causam dor.
- Em cancro do reto:
- Neo-adjuvante: utilizado antes de cirurgia em pacientes com tumores que se estendem além do reto ou invadiram nódulos linfáticos regionais, para diminuir o risco de recorrência após cirurgia ou para permitir uma cirurgia de caráter menos invasivo.
- Adjuvante: quando o tumor perfura o reto ou invade nódulos linfáticos regionais (T3 ou T4, classificação AJCC, ou B ou C na classificação Duke).
- Paliativo: para diminuir ou prevenir sintomas.
Mais de 20% dos pacientes diagnosticados com cancro colorretal possuem metástases (estádio IV) colorretal no momento do diagnóstico, e deste grupo, cerca de 25% possuem metástases isoladas no fígado que podem potencialmente ser removidas por cirurgia. A remoção de tais metástases através de cirurgia curativa presentemente possui probabilidade de sobrevivência de cinco anos de mais de 50%.
[67] Médicos determinam se uma metástase do fígado é removível usando
tomografia computadorizada ou
ressonância magnética pré-cirurgia, mais
ultrassom intraoperativo, e através de palpação direta e visualização durante a removimento. Lesões confinadas no lobo direito do fígado podem ser removidas
en bloc com uma
hepatetomia do lado direito do fígado. Lesões menores na parte central ou esquerdo do fígado podem às vezes ser removidas em "segmentos"anatômicos", enquanto lesões consideráveis no lobo esquerdo são removidas através de uma trisegmentotomia hepática. Tratamento de lesões através de remoção não-anatômicas menores é associado com maior taxa de recorrência. Lesões não inicialmente consideradas aptas à remoção via cirurgia curativa podem ser consideradas posteriormente caso respondam à quimioterapia. Lesões não consideradas aptas à remoção também podem ser tratadas através de ablação de rádio-frequência, crioablação e embolização química.
Pacientes com cancro colorretal e metástases no fígado podem ser tratados em uma única cirurgia, ou em múltiplas cirurgias (neste caso, o tumor no cólon é tradicionalmente removido primeiro), dependendo da condição do paciente para cirurgia prolongada, a dificuldade dos procedimentos cirúgicos envolvidos, e se o cirurgião está disposto a fazer uma cirurgia hepática (potencialmente complexa) em conjunto com a remoção do tumor primário.
Em novembro de 2006, pesquisadores anunciaram que uma
vacina para o tratamento do cancro colorretal foi desenvolvida e testada em ensaios clínicos com resultados bastante promissores.
[69] A nova vacina, chamada de
TroVax, estimula o
sistema imunológico do indivíduo a enfrentar as células cancerígenas. Especialistas acreditam que vacinas baseadas em
terapia genética poderão provar ser um eficiente método de tratamento no futuro, para vários tipos de cancros. Ensaios clínicos fase III estão sendo realizados para pacientes com
cancro renal, e planejado para pacientes com cancro do cólon.
[70]
Como outros tipos de cancro, o diagnóstico de cancro colorretal frequentemente resulta em uma mudança enorme no bem-estar psicológico do paciente. Vários tipos de suporte psicológico são frequentemente oferecidos em hospitais, como
aconselhamento, serviços sociais, suportes em grupo de cancro, entre outros. Tais serviços ajudam a mitigar algumas das dificuldades em integrar as complicações médicas causadas pelo cancro em outros aspectos da vida do paciente.
[71]
Um estudo em
2009 mostrou que
aspirina reduz o risco de
neoplasia colorretal em provas aleatórias, e inibe crescimento do tumor e metástases em animais. Porém, a influência da aspirina nas taxas de sobrevivência pós-diagnóstico do cancro colorretal é desconhecida..
[72]

Microfoto de um
adenoma viloso colorretal. Estas lesões são consideradas pré-cancerígenas.
O objetivo do monitoramento pós-tratamento (ou
follow-up) é diagnosticar o mais rápido possível quaisquer metástases ou tumores que desenvolveram-se posteriormente, mas não se originaram do tumor original. A ASCO e o
National Comprehensive Cancer Network dão as seguintes recomendações para o
follow-up do cancro colorretal.
[73][74] Uma
história médica em conjunto com uma
examinação física são recomendadas a cada três a seis meses, por dois anos, e após, a cada seis meses, por cinco anos. Exame de nível de antígeno carcinoembriônico no sangue segue o mesmo padrão de tempo, mas é somente aconselhável em pacientes com T2 ou lesões mais severas, e que são candidatos a cirurgia curativa. Tomografia computadorizada do peito, abdômen e do pélvis pode ser considerado anualmente nos primeiros três anos para pacientes com alta chance de recorrência (por exemplo, pacientes com tumores pouco diferenciáveis ou invasão venosa e/ou linfática), pós-cirurgia. Uma colonoscopia pode ser realizada após um ano, exceto se este procedimento não pôde ser realizado como método de estagiamento; neste caso, uma colonoscopia deve ser realizada três a seis meses após a cirurgia. Se um
pólipo viloso, pólipo com mais de um centímetro, ou uma
displasia de alto grau são encontrados, a colonoscopia pode ser repetida após três anos, e então, a cada cinco anos. Para qualquer outra abnormalidade, a colonoscopia pode ser repetida após um ano.
Tomografia por emissão de positrões, ultrassom, raios-X, um exame completo de sangue ou exames de fígado periódicos não são recomendados.
[73][74] Esta recomendação é baseada em metanálises recentes mostrando que vigiamento intensivo e monitoramento pós-tratamento pode reduzir a mortalidade de cinco anos de 37% para 30%.
[75][76][77]
Em
Portugal, a taxa de mortalidade é de 1,8 para cada 100 mil homens, e 2,5 para mulheres, semelhante à de outros países da
União Europeia.
[78] No
Brasil, estima-se que cerca de 27 mil pessoas foram diagnosticadas com cancro colorretal em 2008, com mulheres sendo mais afetadas do que homens (12,5 mil homens e 14,5 mil mulheres)
[79]
Nos Estados Unidos e no
Canadá, o cancro colorretal atinge mais homens do que mulheres
[80] (10,5 mil homens e 9 mil mulheres, no Canadá, em 2005, com 8,4 mil mortes no mesmo ano).
[14] O risco de uma pessoa ter cancro colorretal na vida é de 7% nos
EUA. Estima-se que cerca de 150 mil americanos são diagnosticados todo ano, causando aproximadamente 50 mil mortes.
O cancro colorretal é o terceiro cancro mais comum no mundo ocidental, atrás apenas do
cancro de pulmão e do
cancro de mama (não incluindo carcinomas
basocelulares e
espinocelulares), e o segundo em número de mortes (atrás do cancro de pulmão). Nos países desenvolvidos, a mortalidade cinco anos após diagnóstico varia entre 30% a 40%.
Ver também
Colite ulcerosa
Origem: Wikipédia, a enciclopédia livre.
Saltar para a navegaçãoSaltar para a pesquisa
| Colite ulcerosa |
|---|
|
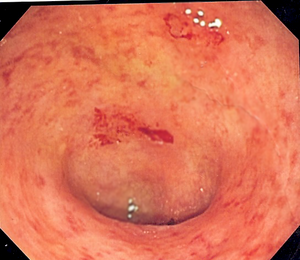
Imagem endoscópica de um cólon sigmóide afetado por colite ulcerosa. Note o padrão vascular da granularidade do cólon e a friabilidade focal da mucosa. |
| Sinónimos | Colite ulcerativa |
| Especialidade | Gastroenterologia |
| Sintomas | Dor abdominal, diarreia com sangue, perda de peso, febre, anemia[1] |
| Complicações | Megacólon, inflamação dos olhos, articulações ou fígado, cancro do cólon[1][2] |
| Início habitual | 15–30 anos ou > 60 anos[1] |
| Duração | Crónica[1] |
| Causas | Desconhecidas[1] |
| Método de diagnóstico | Colonoscopia com biópsia[1] |
| Condições semelhantes | Disenteria, doença de Crohn, colite isquémica[3] |
| Tratamento | Alterações na dieta, medicação, cirurgia[1] |
| Medicação | Sulfassalazina, mesalazina, esteroides, imunossupressores como a azatioprina, terapêutica biológica[1] |
| Frequência | Até 5 em cada 1000 pessoas[4] |
| Mortes | 47 400 em conjunto com Crohn (2015)[5] |
| Classificação e recursos externos |
|---|
| CID-10 | K51 |
| CID-9 | 556 |
| OMIM | 191390 |
| DiseasesDB | 13495 |
| MedlinePlus | 000250 |
| eMedicine | med/2336 |
| MeSH | D003093 |
 Leia o aviso médico Leia o aviso médico |
Em conjunto, a doença de Crohn e a colite ulcerosa afetavam cerca de 11,2 milhões de pessoas em 2015.
[9] A cada ano registam-se 1–20 novos casos por cada 100 000 pessoas, sendo afetados 5–500 por cada 100 000 indivíduos.
[6][8] A doença é mais comum na Europa e na América do Norte do que no resto do mundo.
[8] Na maior parte dos casos a colite ulcerosa tem início entre os 15 e 30 anos de idade ou em pessoas com mais de 60 anos.
[1] A doença aparenta afetar homens e mulheres em igual proporção.
[6] A frequência tem vindo a aumentar desde a década de 1950.
[6][8] A primeira descrição da doença foi feita na década de 1850.
[8]
A doença cursa com inflamação destrutiva de toda a parede do
cólon e
recto, de forma contínua (diferentemente da
doença de Crohn). Inicialmente limita-se à
mucosa, mas depois surgem múltiplas pequenas
úlceras na parede intestinal, devido à inflamação profunda.
A destruição da parede e das
vilosidades gera
diarreia e má-absorção, por vezes com sangue ou
muco, e acompanhada de
febre e
dores abdominais, e por vezes vómitos e náuseas. É comum o
tenesmo, uma sensação de que o recto ainda contem fezes mesmo após a evacuação estar completa. Os períodos sintomáticos alternam com períodos alargados sem qualquer sintoma. Muitos indivíduos apresentam progressão lenta e lesões mínimas, outros rápida ou mesmo fulminante com problemas agudos possíveis adicionais como desidratação e
anemia. Num terço dos casos todo o cólon está afectado, nos restantes algumas áreas são poupadas. São ainda frequentes as fissuras anais (15% dos casos) ou abcessos rectais.
Cerca de metade (47%) dos pacientes possuem signos e sintomas fora do intestino, que podem incluir
[10]:
A longo prazo podem surgir problemas como:
O risco de
cancro do cólon é muito aumentado: 30% desenvolvem carcinomas após várias décadas, mas se detectados precocemente podem ser removidos sem sequelas.
Raramente podem surgir complicações extra-intestinais tais como:
eritemas cutâneos,
artralgias,
artrites, lesões hepáticas ou pancreáticas, e outras.
Não tem uma causa conhecida (
idiopática), mas existem estudos que apontam para uma componente
genético no desenvolvimento da doença.
A teoria mais provável será a de infecção por um microorganismo pouco patogénico que estimula uma resposta
imunitária ineficaz em indivíduos com determinados
genes do sistema
MHC de reconhecimento de
antigénios estranhos. Mesmo após eliminação do invasor, a resposta imunitária permanece e aumenta particularmente em períodos de
stress.
Recentemente,
[11] uma equipe de médicos do
Canadá e
E.U.A. descreveu que
mutações no
gene IL23R, do
cromossomo 1p31 (que codifica uma subunidade do
receptor para a
interleucina 23) estariam associadas a risco aumentado ou reduzido de desenvolver uma doença inflamatória intestinal. O achado suporta a hipótese de que a DII teria uma base genética para a sua etiologia e indica novas linhas de pesquisa em busca de tratamentos mais eficazes.
O tratamento minimiza os problemas e evita complicações graves. São dados
fármacos antidiarreicos e outros para alivio sintomático. O uso de
aminosalicilatos (anti-inflamatórios semelhantes aos
AINEs) diminui as lesões inflamatórias. Para este fim também podem ser utilizados os
corticosteroides, não sendo no entanto primeira escolha devido aos seus efeitos secundários.
Outros medicamentos usados no tratamento da colite ulcerosa são os imunossupressores e o
infliximab. Em casos graves o
cólon é removido cirurgicamente (
colectomia), a única cura definitiva da colite.
Mesmo em casos moderados é necessária a vigilância anual por colonoscopia de possíveis tumores, devido ao risco de cancro colorretal muito aumentado.
A manutenção de dieta rigorosa, pobre em lipídeos, fibras longas e substâncias irritantes do
cólon pode auxiliar na remissão.
Devido ao elevado risco de anemia, recomenda-se
hemogramas regulares com suplementação de vitaminas B e C e ferro conforme necessário durante as crises.
[12]
A colite ulcerosa geralmente é intermitente, com períodos de inatividade e reativação da doença. Pacientes com colite extensa tem menor tempo de remissão e pior prognóstico. A mortalidade é baixa (5% após 10 anos de doença) se o doente é acompanhado e tratado. Cerca de 25% sofrem ataques severos com necessidade de
colectomia nos primeiros anos.
Afecta principalmente indivíduos com 15 a 25 anos e depois com 60-80 anos, sendo mais comum as mulheres que os homens. A
incidência é de 10 novos casos por 100.000 pessoas, sendo mais frequente nos ocidentais que nos orientais, onde a incidência tem crescido nos últimos anos. A incidência em algumas etnias judaicas, especialmente Ashkenazi, é mais de dez vezes maior que o resto da população. A prevalência mundial está entre 100-300 casos por 100.000 adultos (cerca de 0,2%).
[13]