Cancro da mama
| Cancro da mama Câncer de mama | |
|---|---|
| Mamografia de uma mama normal (esquerda) e de uma mama com cancro (direita, setas brancas). | |
| Especialidade | Oncologia |
| Sintomas | Nódulo numa mama, alterações na forma da mama, retração da pele, líquido no mamilo, pele vermelha e escamosa[1] |
| Fatores de risco | Sexo feminino, obesidade, falta de exercício, consumo de álcool, terapia de substituição hormonal durante a menopausa, radiação ionizante, menarca em idade precoce, ter tido filhos tarde ou não ter tido filhos, idade avançada, antecedentes familiares, síndrome de Klinefelter[1][2][3] |
| Método de diagnóstico | Biópsia[1] |
| Tratamento | Cirurgia, radioterapia, quimioterapia, terapia hormonal, terapia dirigida[1] |
| Prognóstico | Taxa de sobrevivência a 5 anos: ~85% (EUA, Reino Unido)[4][5] |
| Frequência | 2,1 milhões (2015)[6] |
| Mortes | 533 600 (2015)[7] |
| Classificação e recursos externos | |
| CID-10 | C50 |
| CID-9 | 174-175 |
| OMIM | 114480 |
| DiseasesDB | 1598 |
| MedlinePlus | 000913 |
| eMedicine | med/2808 |
| MeSH | D001943 |
Cancro da mama (português europeu) ou câncer de mama (português brasileiro) ou carcinoma da mama é o cancro que se desenvolve no tecido mamário.[8] Entre os sinais de cancro da mama estão o aparecimento de um nódulo na mama ou perto da mama na zona da axila; alterações na forma ou na aparência da mama, como retração do mamilo, pele da mama ou aréola, mamilo com aparência escamosa, vermelha, inchada ou com saliências e reentrâncias; ou ainda sensibilidade no mamilo e secreção ou perda de líquido pelo mamilo. Em pessoas com a doença disseminada, pode também verificar-se dor óssea, gânglios linfáticos inchados, falta de ar e icterícia.[9]
Entre os fatores de risco para o desenvolvimento de cancro da mama estão o sexo feminino, a idade, obesidade, falta de exercício físico, o consumo de álcool, a terapia de reposição hormonal durante a menopausa, radiação ionizante, idade precoce da primeira menstruação, ter filhos em idade tardia ou não ter tido filhos.[1][2] Entre 5 e 10% dos casos são causados por genes herdados dos pais da pessoa, entre os quais o BRCA1 e o BRCA2. O cancro da mama geralmente desenvolve-se nas células do revestimento dos canais mamários e dos lóbulos onde é produzido o leite. Os cancros que se desenvolvem nos canais são denominados carcinomas ductais, enquanto que os que se desenvolvem nos lóbulos são denominados carcinomas lobulares.[1] Existem ainda mais 18 sub-tipos de cancro da mama. Alguns cancros desenvolvem-se a partir de condições pré-malignas como o carcinoma ductal in situ.[2] O diagnóstico de cancro da mama é confirmado através de uma biópsia do nódulo em questão. Uma vez realizado o diagnóstico, são realizados mais exames para determinar se o cancro se disseminou para além da mama e a que tratamentos pode responder.[1]
A ponderação entre as vantagens e desvantagens do rastreio do cancro da mama ainda é um tópico controverso. Uma revisão de 2013 da Cochrane afirmou que não é claro que o rastreio mamográfico tenha mais benefícios ou malefícios.[10] Outra revisão de 2009 por um grupo de trabalho dos EUA (US Preventive Services Task Force) encontrou evidências de benefícios em pessoas com 40 a 70 anos de idade,[11] tendo recomendado o rastreio a cada dois anos para as mulheres entre os 50 e 74 anos de idade.[12]
Como medida de prevenção, em pessoas com risco elevado de desenvolver cancro da mama, podem ser usados os fármacos tamoxifeno e raloxifeno. Outra medida de preventiva em mulheres com risco agravado é a remoção cirúrgica de ambas as mamas.[2] Em pessoas a quem foi diagnosticado cancro, estão disponíveis uma série de tratamentos, incluindo cirurgia, radioterapia, terapia hormonal e terapia direcionada.[1] Dependendo do tipo de intervenção necessário, a cirurgia pode conservar a mama (p.e. quadrantectomia) ou ser realizada uma mastectomia. A reconstrução de mama pode ter lugar durante a cirurgia ou numa data posterior. Nas pessoas em que o cancro já se disseminou para outras partes do corpo, os tratamentos destinam-se sobretudo a prolongar a vida, melhorar o conforto e a qualidade de vida.[13]
O prognóstico para o cancro da mama varia em função do tipo de cancro, extensão da doença e idade da pessoa.[13] A taxa de sobrevivência em países desenvolvidos é elevada,[14] sendo mais reduzida nos países em vias de desenvolvimento.[2] Quando se considera todo o mundo, o cancro da mama é a causa mais comum de cancro em mulheres, correspondendo a 25% de todos os casos.[15] Em 2012 foi responsável por 1,68 milhões de casos e 522 000 mortes.[15] É mais comum em países desenvolvidos[2] e é mais de 100 vezes mais comum em mulheres do que em homens.[14][16]
Sinais e sintomas
O primeiro sintoma percetível de cancro da mama é geralmente o aparecimento de um nódulo na mama ou na zona dos gânglios linfáticos das axilas, cuja sensação durante a palpação é diferente do tecido envolvente. Mais de 80% dos casos de cancro da mama são descobertos quando a mulher sente um nódulo durante a palpação.[17] Para além dos nódulos, entre os sinais de um possível cancro da mama estão um espessamento diferente do restante tecido mamário; alterações na forma, tamanho ou aparência de uma mama; a retração ou alteração de posição ou forma de um mamilo; pele da mama, aréola ou mamilo com aparência escamosa, vermelha, inchada ou com saliências e reentrâncias; secreção ou perda de líquido pelo mamilo; dor constante em parte da mama ou da axila e inchaço por baixo da axila ou à volta da clavícula.[1][18][19]
O carcinoma inflamatório da mama é um tipo particular de cancro da mama cujo diagnóstico é bastante difícil, uma vez que não se manifesta através de um nódulo palpável. Os sintomas podem-se assemelhar a uma inflamação das mamas, incluindo prurido, dor, inchaço, inversão do mamilo, calor, vermelhidão por toda a mama e textura da pele semelhante a uma casaca de laranja.[17] Em alguns casos, o cancro da mama apresenta-se como doença metastática; ou seja, cancro que se disseminou no corpo para além do órgão inicial. Os sintomas causados pelo cancro da mama metastático dependem da localização das metástases. Os locais mais comuns são os ossos, fígado, pulmões e cérebro.[20]
A doença de Paget da mama é uma síndrome maligna que é responsável por 1 a 4,3% de todos os cancros da mama. Manifesta-se através de alterações na pele semelhantes ao eczema, como vermelhidão, descoloração ou escamamento da pele do mamilo. À medida que a doença avança, os sintomas incluem formigueiro, prurido, aumento da sensibilidade e dor, podendo também verificar-se secreções do mamilo. Cerca de metade das mulheres diagnosticadas com doença de Paget da mama também apresentam um nódulo no peito.[21] Em casos raros, aquilo que inicialmente aparenta ser um fibroadenoma (nódulo duro, móvel e não-canceroso) pode na realidade ser um tumor filoide, responsável por 0,5% dos cancros da mama. Estes tumores formam-se no estroma (tecido conjuntivo) da mama e são classificados em benignos, duvidosos ou malignos.[22]
Existem também sintomas não específicos de cancro da mama; isto é, sintomas que também podem ser manifestações de outras doenças. A perda de peso inexplicável pode por vezes ser um sinal de cancro da mama, assim como sintomas de febre e calafrios. As dores nos ossos ou articulações, icterícia e sintomas neurológicos podem por vezes ser manifestações de cancro da mama metastático.[23] A dor nas mamas é uma ferramenta pouco fidedigna para determinar a presença ou ausência de cancro da mama, mas pode ser indicativa de outras doenças mamárias.[17][24][25]
A maior parte dos casos de sintomas de doenças mamárias não implicam um diagnóstico de cancro. Por exemplo, só menos de 20% dos nódulos detectados é que revelam ser cancerígenos.[26] As doenças benignas da mama, como a mastite e o fibroadenoma, são causas muito mais comuns dos sintomas aqui descritos. No entanto, a aparição de qualquer sintoma deve ser levada a sério, uma vez que existe a possibilidade de se tratar de cancro da mama, qualquer que seja a idade da pessoa.[27]
Fatores de risco
Os fatores de risco para o cancro da mama podem ser divididos em duas categorias: modificáveis e não modificáveis. Os modificáveis são comportamentos que as próprias pessoas podem alterar, como o consumo de bebidas alcoólicas, enquanto que os não modificáveis são fatores que não podem ser alterados, como a idade ou o sexo da pessoa.[28] Os principais fatores de risco para o cancro da mama são o sexo feminino e progressão da idade.[29] Entre outros potenciais fatores de risco estão fatores genéticos, não ter tido filhos ou não ter amamentado,[30] a maior quantidade de determinadas hormonas,[31] e a obesidade, principalmente após a menopausa.[32]
Estilo de vida
Fumar aparenta aumentar o risco de cancro de mama. O risco aumenta de forma proporcional à quantidade fumada e a quanto mais cedo na vida se começou a fumar. Em fumadores veteranos, o risco é entre 35% e 50% maior do que em não fumadores.[33] Cerca de 10% dos casos da doença estão relacionados com a ausência de atividade física.[34] Permanecer sentado regularmente e por longos períodos de tempo está associado a uma maior mortalidade do cancro da mama. Este risco não desaparece com o exercício regular, embora haja uma diminuição.[35]
Existe uma relação entre a dieta e o cancro da mama. O risco da doença é maior com uma dieta rica em gorduras,[36] com a ingestão de álcool,[37] e com a obesidade relacionada com níveis excessivos de colesterol.[38] A insuficiência de iodo na dieta pode também influenciar o risco.[39]
Existe uma associação entre a contraceção hormonal e o desenvolvimento de cancro da mama durante a pré-menopausa,[28][40] embora esteja ainda a ser debatido se o uso de contracetivos orais causa de facto a doença. No entanto, mesmo que haja alguma relação, o efeito global será pouco significativo.[41] Além disso, não é claro se essa associação ainda continua a existir com os contracetivos orais de última geração.[41] Em pessoas com mutações genéticas que causam predisposição para cancro da mama (genes BRCA1 ou BRCA2) ou que têm antecedentes familiares de cancro da mama, o uso de contracetivos orais de última geração não aparenta ter qualquer influência no risco de cancro da mama.[42][43] As mutações que podem causar cancro da mama têm sido associadas experimentalmente à exposição ao estrogénio.[44]
A associação entre amamentação e o cancro da mama ainda não está inequivocamente demonstrada. Alguns estudos apontam a existência de uma associação enquanto outros não.[45] No início da década de 1980, foi levantada a hipótese de que o aborto induzido aumentava o risco de vir a desenvolver cancro da mama.[46] No entanto, esta hipótese foi alvo de investigação extensa nas décadas seguintes, tendo a comunidade científica concluído que nem o aborto induzido nem o aborto espontâneo estão associados a qualquer aumento do risco de cancro da mama.[47]
Entre outros fatores de risco estão a radiação,[48] e o trabalho por turnos.[49] Estão também associados ao aumento do risco alguns produtos químicos, como o bifenilpoliclorado, hidrocarbonetos aromáticos policíclicos, solventes orgânicos[50], determinados pesticidas[51] e possivelmente substâncias químicas em tintas permanentes e produtos para alisar cabelo.[52] Embora a radiação recebida durante uma mamografia seja em doses muito baixas, estima-se que o rastreio anual entre os 40 e os 80 anos de idade seja a causa de aproximadamente 225 casos fatais de cancro da mama por cada milhão de mulheres rastreadas.[53]
Genética
Acredita-se que a predisposição genética seja a principal causa de 5 a 10% de todos os casos de cancro da mama[54] e que possa ter um papel menor na maioria dos restantes casos.[55] Em menos de 5% dos casos, a genética tem um papel mais ativo ao causar síndrome de cancro hereditário da mama e ovário em pessoas com mutações nos genes BRCA1 e BRCA2[55] que são supressores tumorais, responsáveis por regular alguns fatores do metabolismo celular, como reparação do DNA e expressão gênica, tal mutação resulta na perda de função desses dois genes, provocando o efeito carcinogênico[56]. Estas mutações correspondem a 90% do total de influência genética, com um risco de cancro da mama de 60 a 80% em pessoas afetadas.[54] Entre outros genes com mutações significativas estão o p53 (síndrome de Li-Fraumeni), PTEN (síndrome de Cowden), STK11 (síndrome de Peutz–Jeghers), CHEK2, ATM, BRIP1 e PALB2.[54]
Em pessoas com nenhum, um ou dois parentes afetados, o risco de cancro da mama antes dos 80 anos de idade é de 7,8%, 13,3% e 21,1%, respetivamente, sendo a mortalidade da doença de 2,3%, 4,2% e 7,6%, também respetivamente.[57] Em pessoas com um parente em primeiro grau com a doença, o risco de vir a ter cancro da mama entre os 40 e 50 anos de idade é o dobro em relação à generalidade da população.[58]
O gene GATA3 controla diretamente a expressão dos recetores de estrogénio e de outros genes associados com a diferenciação epitelial. A perda do GATA3 provoca a perda de diferenciação e um diagnóstico menos favorável devido à invasão celular e metástase.[59]
Condições médicas
Algumas alterações nas mamas, como a hiperplasia ductal atípica e o carcinoma lobular in situ, que ocorrem em doenças benignas, estão relacionadas com o aumento do risco de cancro da mama. A diabetes pode também aumentar o risco da doença.[60][61]
Fisiopatologia
O cancro da mama, tal como qualquer outro cancro, ocorre devido a uma interação entre fatores ambientais e um hospedeiro geneticamente predisposto. O cancro da mama é uma disfunção celular em que as células epiteliais crescem e se multiplicam de forma desordenada.[62] Enquanto que as células normais são capazes de controlar a sua multiplicação, de se unir a outras células e de permanecer no devido local nos tecidos, as células cancerígenas não têm mecanismos que impeçam a sua multiplicação, não precisam de de se unir a outras células para sobreviver e invadem os tecidos próximos. As células normais suicidam-se quando já não são necessárias. Até chegar o momento certo, esta morte programada é impedida por vários tipos de proteínas e vias metabólicas. Ocasionalmente, os genes que codificam as proteínas destas vias protetoras podem sofrer mutações, o que faz com que estas proteínas alteradas tornem a célula resistente aos estímulos para cometer suicídio. Estas mutações podem levar ao cancro. Por exemplo, numa situação normal a proteína PTEN desliga a via PI3K/AKT quando a célula está pronta para se suicidar. Em alguns cancros da mama, o gene da proteína PTEN encontra-se mutado, pelo que a via PI3K/AKT encontra-se permanentemente ligada, aumentado a resistência ao suicídio celular (morte celular programada).[63]
O perfil genómico é importante para caracterizar os subtipos de cancro da mama invasivo. O estrogénio é uma hormona produzida principalmente pelos ovários e placenta. Estão identificados vários mecanismos pelos quais esta hormona pode causar cancro da mama, incluindo a ligação do estradiol (E2) aos recetores de estrogénio (ER). O E2 regula o crescimento, a diferenciação celular e vários processos fisiológicos, mas estes efeitos são mediados pelos recetores de estrogénio presentes no tecido mamário nas isoformas RE-α e RE-β. Cerca de 70% dos cancros da mama apresenta níveis elevados de RE-α e níveis baixos de RE-β, o que sugere que o RE-α está associado à carcinogénese, enquanto o RE-β parece ter um efeito protetor.[62][64][65] A progesterona atua nos recetores de progesterona, cuja expressão é estimulada pelos recetores de estrogénio.[62][66] O oncogene HER2/neu produz a proteína HER2 e codifica a glicoproteína transmembranar 185KDa. Quando é produzida em baixos níveis, a proteína HER2 regula o crescimento celular normal. Em 15-30% dos carcinomas invasivos da mama observa-se sobre-expressão ou amplificação do gene HER2.[62][67] Eventuais anomalias na sinalização dos fatores de crescimento entre as células estromais e as células epiteliais podem facilitar o crescimento celular maligno.[68][69] No tecido adiposo da mama, a sobre-expressão da leptina leva ao aumento da proliferação celular e ao aparecimento de cancro.[70]
Nos Estados Unidos, 10 a 20% das pessoas com cancro da mama e cancro dos ovários têm um parente em primeiro ou segundo grau com uma destas doenças. A tendência familiar para desenvolver estes tipos de cancro é denominada síndrome hereditário de cancro da mama e ovário. O caso melhor estudado é o da mutação do gene BRCA1 que confere risco de cancro da mama ao longo da vida de 60 a 85% e risco de cancro dos ovários de 15 a 40%. Algumas mutações genéticas associadas com o cancro, como é o caso dos genes p53, BRCA1 e BRCA2, ocorrem em proteínas que têm como função corrigir erros na codificação do ADN. Estas mutações são hereditárias ou adquiridas após o nascimento. Presumivelmente, permitem o acumular de mutações posteriores, o que pode provocar divisão celular descontrolada e ulteriormente cancro.[48][71] No entanto, há fortes evidências de variação do risco individual para cancro da mama que vão muito para além das mutações dos genes BRCA entre famílias de portadores. Isto é causado por fatores de risco não observáveis,[72] o que implica que o cancro da mama é despoletado por fatores ambientais e outras causas. A mutação hereditária dos gentes BRCA1 ou BRCA2 pode interferir com a reparação de crosslinks (ligações cruzadas) do ADN e de quebras na cadeia dupla de ADN.[73] Certos carcinogénios provocam danos no ADN, como crosslinks e quebras na cadeia dupla, que frequentemente necessitam de ser reparados por vias que contêm os genes BRCA1 e BRCA2.[74][75] No entanto, as mutações nos genes BRCA são responsáveis por apenas 2-3% de todos os cancros da mama.[76]
Diagnóstico
A consulta de um profissional de saúde e o início dos exames tem geralmente início quando é descoberta uma massa ou calcificações anormais numa mamografia de rastreio, ao notar um nódulo na mama ou debaixo do braço durante o auto-exame ou exame clínico ou ainda ao notar uma mama vermelha e inchada. Os exames de diagnóstico permitem detectar e distinguir o cancro da mama de outro tipo de lesões benignas, como simples quistos, conhecer com precisão o estádio do cancro, saber se existem metástases em outras partes do corpo fora da mama e dos gânglios linfáticos axilares e ajudar a determinar o tratamento mais eficaz.[77][78] Os exames de diagnóstico mais comuns são as mamografias e as biópsias. As mamografias são capazes de detetar um cancro da mama, mesmo nas fases iniciais.[24] Uma biópsia consiste na recolha de uma pequena quantidade de tecido ou de células para ser observada ao microscópio e é a única forma de confirmar o diagnóstico de muitos tipos de cancro. Para além da biópsia, ou quando não é possível realizar uma biópsia, estão disponíveis uma série de exames de diagnóstico complementares.[77] A combinação do exame físico, mamografia e biópsia por agulha permite diagnosticar cancro da mama com elevado nível de precisão.[79]
Imagiologia
Os exames imagiológicos mais comuns são a mamografia, ecografia e ressonância magnética. A mamografia é o primeiro exame de diagnóstico quando uma mulher nota sintomas de um possível cancro da mama, como o aparecimento de uma massa na mama ou descargas mamilares, ou quando uma mamografia de rastreio indica qualquer elemento suspeito. A mamografia de diagnóstico usa raios X para produzir várias imagens (mamogramas) que permitem detectar e observar tumores e outras irregularidades na mama que não são detectáveis apenas por palpação. A ecografia usa ondas sonoras de elevada frequência para produzir imagens do tecido mamário e permite distinguir uma massa sólida, que pode ser cancro, de um quisto com fluido, que geralmente não é cancro. Uma ressonância magnética usa campos magnéticos para produzir imagens do corpo de elevado detalhe, podendo ser usada para medir o tamanho do tumor e avaliar a extensão da doença para além da mama. A obtenção de imagens pode ser melhorada com a injeção de um meio de contraste.[77]
Para além destes exames estão disponíveis exames complementares como a cintigrafia óssea, a tomografia computorizada e a tomografia por emissão de positrões. No entanto, estes exames só estão recomendados para doentes em estádios avançados. Em casos com baixo risco de metástase, os riscos associados com estes exames são superiores aos possíveis benefícios, uma vez que estes procedimentos expõem o paciente a uma quantidade significativa de radiação ionizante.[80] A cintigrafia óssea permite detectar matástases no interior dos ossos mediante a injeção no doente de um agente radioativo que depois é fotografado com câmaras especiais. O agente aglomera-se nas zonas que se encontram em cicatrização como resposta a células cancerosas, resultando em áreas mais escuras na imagem. No entanto, este exame não detecta todos os cancros e a artrite avançada ou a cicatrização de uma fractura podem gerar falsos positivos. A tomografia computorizada permite detectar tumores nos órgãos fora da mama. A tomografia combina várias imagens de raio X para produzir uma imagem tridimensional e bastante detalhada do corpo, permitindo também medir o tumor e confirmar se se encontra em regressão com o tratamento. A tomografia por emissão de positrões permite também detectar metástases em órgãos para além da mama, mediante a injeção de uma substância açucarada na corrente sanguínea do doente. Como as células cancerosas consomem mais energia, as áreas de maior atividade aparecem na imagem como pontos brilhantes.[77]
Biópsia
Uma biópsia consiste na recolha de uma pequena quantidade de tecido ou de células da área suspeita que é depois analisada ao microscópio por um patologista. A biópsia é o único exame que permite confirmar um diagnóstico definitivo de cancro. Os restantes exames apenas sugerem a possibilidade do cancro estar presente. A maior parte dos tipos de cancro da mama são facilmente diagnosticáveis por biópsia, embora alguns tipos raros possam necessitar de exames de laboratório especializados. Há vários tipos de biopsias, classificados de acordo com a técnica ou tamanho da agulha usada. Na biópsia de diagnóstico, a técnica geralmente usada é a biópsia por agulha grossa, em que é inserida uma agulha para recolher uma amostra de tecido da massa suspeita. Pode também ser usada a técnica de biópsia por agulha fina, em que o diâmetro da agulha é menor e é recolhida apenas uma amostra de células ou de líquido. A presença de líquido transparente geralmente indica que o nódulo não é cancerígeno. Por outro lado, se o líquido contiver sangue, pode ser analisado ao microscópio para detetar a presença de células cancerígenas.[77][79]
Pode ainda ser usada a técnica de biópsia a vácuo, que remove grandes quantidades de tecido. Quando o nódulo suspeito não é acessível à palpação e só é visível numa mamografia, a biópsia pode ser guiada por mamografia, ecografia ou ressonância magnética.[77] Uma biópsia cirúrgica permite remover uma grande quantidade de tecido. A biópsia cirúrgica pode ser incisional, em que se remove apenas parte do tumor, ou excisional, em que o tumor é removido por completo. No entanto, este tipo de biópsia não é recomendada para o diagnóstico, sendo usada quando já existe um diagnóstico de cancro confirmado.[77][79]
A análise laboratorial da amostra recolhida pela biópsia permite conhecer as características do cancro e ajuda a definir a melhor opção de tratamento. Entre as características, a análise determina se o tumor é invasivo ou in situ, ductal ou lobular e se o cancro se espalhou para os gânglios linfáticos ou não. A análise permite também avaliar se o cancro é positivo ao receptores hormonais (ER+ e PR+), de modo a determinar o risco de recorrência da doença e qual o tratamento com melhor probabilidade de diminuir esse risco, e se é positivo ao gene do receptor-2 do factor de crescimento epidérmico humano (HER2+), o que permite saber se o tratamento com anticorpos é eficaz. É também a partir da biópsia que se determina o grau do tumor; ou seja, quão diferentes são as células cencerosas das células normais e se elas aparentam crescer lentamente ou rapidamente.[77]
Análises ao sangue
As análises ao sangue permitem a realização de vários exames. Um hemograma permite contabilizar o número de diferentes células no sangue, como eritrócitos e leucócitos, garantindo que a medula óssea funciona corretamente. A análise bioquímica permite avaliar se os minerais no corpo, como cálcio e potássio, ou as enzimas têm valores anormais, o que pode significar que o cancro apresenta metástases. No entanto, há numerosas condições não cancerosas que podem interferir com estes exames. A presença da enzima fosfatase alcalina está associada à disseminação da doença para o fígado, ossos ou ductos biliares. Níveis elevados de cálcio no sangue podem significar que o cancro se disseminou para os ossos. Níveis elevados de bilirrubina e das enzimas alanina aminotransferase (ALT) e aspartato aminotransferase (AST) podem ser um sinal de que o cancro se disseminou para o fígado. Os exames de hepatite permitem avaliar se a pessoa esteve exposta anteriormente a hepatite B ou C, podendo assim necessitar de medicação especial em caso de quimioterapia para evitar lesões no fígado. Os exames aos marcadores tumorais detectam a presença de proteínas do tumor no sangue.[77]
Classificação
Existem vários sistemas para classificar os diferentes tipos de cancro da mama. A classificação dentro de cada um destes sistemas influencia a escolha do tratamento e o prognóstico da doença. A descrição de um cancro da mama deverá preferencialmente incluir todos os aspetos. Uma classificação completa engloba o tipo histopatológico, grau, estádio, estado dos recetores hormonais e a presença ou ausência de determinados genes.[81]
Tipos histopatológicos
O cancro da mama pode ser classificado de acordo com a sua aparência histológica. A maior parte dos tumores malignos da mama tem origem em carcinomas no tecido epitelial. Os carcinomas da mama, embora muitas vezes discutidos na qualidade de uma única doença, são na realidade um grupo diversificado de lesões que diferem entre si na aparência ao microscópio e no comportamento biológico. A sua classificação depende das características citológicas das lesões, do tipo de recetores que as células apresentam e da sua velocidade de proliferação, e não da localização no sistema ductal-lobular mamário.[82] Quando o crescimento das células pré-malignas é restrito a um determinado compartimento, sem invadir o tecido envolvente, denomina-se "carcinoma in situ". Pelo contrário, quando o carcinoma não se restringe ao compartimento inicial denomina-se "carcinoma invasivo".[83]
Os dois tipos de carcinomas da mama mais comuns são os carcinomas ductais e os carcinomas lobulares. Os carcinomas ductais são a causa mais comum da doença, responsáveis por 76% dos diagnósticos, enquanto que os lobulares são a segunda causa mais comum com 8%.[82] Os carcinomas ductais têm origem nas células que revestem os ductos mamários e dividem-se em carcinomas ductais in situ, um tumor pré-maligno situado apenas no ducto, e carcinomas ductais invasivos, um cancro invasivo que já se disseminou para o exterior do ducto. Os carcinomas lobulares têm origem nos lobos mamários e dividem-se em carcinomas lobulares in situ, uma lesão pré-maligna situada apenas nos lobos, e carcinomas lobulares invasivos, um cancro invasivo que já se disseminou para fora dos lobos. Embora o carcinoma lobular in situ não seja considerado cancro, a sua presença é um fator de risco para desenvolver cancro da mama maligno.[84]
O carcinoma inflamatório da mama é um tipo de cancro agressivo e de crescimento rápido responsável por 1-5% de todos os cancros da mama. A doença de Paget da mama é um tipo de cancro que tem origem nos ductos do mamilo. Embora geralmente in situ, pode também ser invasivo. Entre os tipos menos comuns ou raros de carcinomas da mama estão o carcinoma medular da mama, carcinoma mucinoso, carcinoma tubular, carcinoma metaplásico e carcinoma papilar.[82][84]
Grau
A avaliação do grau histológico compara a aparência das células cancerígenas com a aparência do tecido mamário normal. Quando mais as células cancerosas se aproximarem do normal, menor será o seu crescimento e melhor será o seu prognóstico. Se as células não forem bem diferenciadas, são imaturas, dividem-se mais rapidamente e tendem a disseminar-se. As células normais de um órgão como a mama tornam-se diferenciadas, o que significa que assumem determinadas formas de acordo com a sua função nesse órgão. No entanto, as células cancerígenas perdem esta diferenciação e, em vez de se alinharem de forma organizada para formar os canais mamários, começam a dividir-se de forma descontrolada e o seu núcleo deixa de ser uniforme. O sistema mais amplamente usado para classificar o grau histológico é a escala de Nottingham. Os tumores são classificados em bem diferenciados (grau 1), moderadamente diferenciados (grau 2) e pouco diferenciados (grau3). Os cancros com menor diferenciação têm sido associados a um prognóstico menos favorável.[85]
Estado dos recetores hormonais e HER2
As células possuem recetores hormonais na superfície, no citoplasma e no núcleo. Os mensageiros químicos, como as hormonas, ligam-se a estes recetores para controlar as funções celulares. No caso das células de cancro da mama, durante a biópsia avalia-se se as células possuem dois recetores específicos, os recetores de estrogénio (ER) e de progesterona (PR), assim como se as células têm ou não proteína HER2 em excesso ou cópias extra do gene HER2. Conforme as células possuam ou não estes biomarcadores, o cancro é denominado ER positivo (ER+), ER negativo (ER-), PR positivo (PR+), PR negativo (PR-), HER2 positivo (HER2+) ou HER2 negativo (HER2-). Esta classificação é fundamental para determinar o tipo de tratamento, já que cada tipo responde a tratamentos diferentes.[81]
Quando a biópsia detecta recetores hormonais de estrogénio ou progesterona nas células cancerosas, o tumor é classificado como "sensível a hormonas" (RE+ ou RP+). Estes cancros podem ser tratados com terapia hormonal, a qual diminui os níveis de estrogénio ou bloqueia os recetores de estrogénio. Este tipo de cancro é mais comum após a menopausa, tende a crescer mais lentamente que os restantes tipos e apresenta melhor prognóstico a curto prazo, embora haja maior probabilidade de regressar a longo prazo. Quando não são detetados recetores hormonais, o cancro é classificado como "não sensível a hormonas" (RE-, RP-) e não pode ser tratado com terapia hormonal.[81][86]
Os cancros cujas células apresentam excesso de HER2 ou cópias extra do gene HER2 são denominados "HER positivos" (HER+). Este tipo de cancros e tende a ser mais agressivo, mas pode ser tratado com fármacos que têm por alvo a HER2, como o anticorpo monoclonal trastuzumab. Quando as células não possuem nem recetores hormonais nem excesso de HER2 (ER-, PR-, HER2-), o cancro é classificado como "basaloide" ou "triplo negativo". Este tipo de cancro tende a crescer mais rapidamente que os restantes e, como não tem recetores hormonais, a terapia hormonal é ineficaz. Quando o cancro é simultaneamente sensível a hormonas e apresenta HER2 em excesso, denomina-se "triplo positivo" e pode ser tratado com fármacos hormonais e fármacos que têm por alvo a HER2.[81][87]
Estadiamento
O estadiamento do cancro baseia-se na avaliação da localização, dimensão e extensão do tumor, se existe disseminação para os gânglios linfáticos e se existem metástases noutras partes do corpo. A determinação do estádio é feita após a avaliação do tumor mediante exames médicos. Conhecer o estádio permite escolher a opção de tratamento mais adequada e melhorar o prognóstico da doença. O sistema de estadiamento de cancro da mama mais usado é o sistema TNM. Este sistema avalia o tamanho e localização do tumor principal (T), o grau de propagação para os gânglios linfáticos (N) e metástases à distância (M). A descrição de cada parâmetro difere conforme o tipo de cancro. Os resultados da avaliação destes três parâmetros são então combinados para determinar o estádio do cancro dessa pessoa.[88]
O parâmetro T, seguido de letras ou um número entre 0 e 4, avalia o tamanho e localização do tumor. Os estádios T0 e Tis são situações pré-cancro. Nos estádios T1 a T3 o tumor ainda se encontra restrito à mama e aos gânglios linfáticos regionais. O parâmetro N refere-se à avaliação dos nódulos ou gânglios linfáticos. No caso do cancro da mama, os gânglios regionais são os que se encontram na axila, superiores e inferiores à clavícula e inferiores ao esterno, sendo todos os restantes denominados "distantes". Quando os gânglios são avaliados antes da cirurgia pode ser acrescentado o sufixo "c" (clínico); quando são avaliados na cirurgia, de forma mais precisa, pode ser acrescentado o sufixo "p" (patológico). O parâmetro M refere-se à avaliação das metástases, ou seja, se o cancro se espalhou para outras partes do corpo.[88][89][90]
| T: Tamanho e localização do tumor primário[88][89][90] | ||
|---|---|---|
| T0 | Não há evidências de tumor primário. | |
| Tis | Carcinoma in situ, uma condição pré-maligna em que o tumor está limitado aos ductos ou lóbulos do tecido mamário e ainda não se propagou para os tecidos circundantes. Existem três tipos de carcinomas in situ: "Tis (DCIS)", ou carcinoma ductal in situ, um cancro não invasivo mas que se não for removido pode-se tornar maligno; "Tis (LCIS)", ou carcinoma lobular in situ, que são células anormais nos lóbulos ou glândulas mamárias que, embora não sendo cancro, se pode tornar maligno; e finalmente "Tis Paget", ou doença de Paget da mama uma forma rara e não invasiva de cancro das células da pele do mamilo. | |
| T1 | A parte invasiva do tumor da mama mede até 20 mm na maior extensão. | |
| T2 | A parte invasiva do tumor da mama mede entre 20 e 50 mm. | |
| T3 | A parte invasiva do tumor da mama mede mais de 50 mm. | |
| T4 | Um dos seguintes grupos: | T4a: o tumor já cresceu para além da parede torácica. |
| T4b: o tumor já cresceu para a pele | ||
| T4c: o cancro já se encontra tanto na parede torácica como na pele | ||
| T4d: Carcinoma inflamatório da mama | ||
| N: Gânglios linfáticos | ||
|---|---|---|
| N0 | Não há evidências de cancro nos gânglios linfáticos. | |
| N0(i+) | Observam-se áreas muito pequenas de células tumorais isoladas (<0,2 mm ou <200 células). | |
| N1mic | Ou micrometástase, significa que o cancro nos gânglios linfáticos das axilas é maior do que 0,2 mm, mas menor do que 2 mm e só é possível ser observado ao microscópio. | |
| N2 | O cancro propagou-se para 4 a 9 gânglios da axila ou sob o braço ("N2a") ou para os gânglios internos da mama sem que esteja presente nos da axila ("N2b"). | |
| N3 | Pode significar que o cancro se propagou para 10 ou mais gânglios linfáticos sob o braço, sob a clavícula ou sob o esterno ("N3a"); para os gânglios internos da mama e axilares ("N3b"); ou para os gânglios situados por cima da clavícula ("N3c"). | |
| M: Metástases | ||
|---|---|---|
| M0 | A doença ainda não tem metástases | |
| M0 (i+) | Embora não haja evidências clínicas ou radiográficas de metástases, existem evidências microscópicas de células tumoriais no sangue, medula óssea ou outros gânglios linfáticos. | |
| M1 | Há evidências de metástases e existem células de cancro da mama a crescer noutros órgãos | |
O estádio do cancro da mama é determinado através da combinação dos parâmetros T, N e M.:
| Estádios do Cancro da Mama[88] | |||
|---|---|---|---|
| Estádio | Imagem | Avaliação TNM | Descrição |
| Estádio 0 |  | Tis, N0, M0 (carcinoma ductal in situ) | A doença encontra-se restrita aos ductos e lóbulos do tecido mamário e ainda não se propagou para o tecido envolvente. Também se denomina cancro não invasivo. |
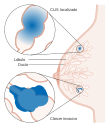 | Tis, N0, M0 (carcinoma lobular in situ) | ||
| Estádio 1A |  | T1, N0, M0 | Tumor pequeno, invasivo, mas que ainda não se espalhou para os gânglios linfáticos. |
| Estádio 1B |  | T0 ou T1, N1mic, M0 | O cancro espalhou-se apenas para os gânglios linfáticos e é maior do que 0,2 mm e menor que 2 mm. Não existem evidências de tumor na mama ou o tumor é menor ou igual a 20 mm. |
| Estádio 2A |  | T0, N1, M0 | Não há evidências de tumor na mama, mas o cancro espalhou-se para os gânglios linfáticos axilares, embora não para outras partes do corpo |
| T1, N1, M0 | O tumor é igual ou menor a 20 mm e espalhou-se para os gânglios linfáticos axilares | ||
 | T2, N0, M0 | O tumor é maior que 20 mm e menor que 50 mm e ainda não se espalhou para os gânglios linfáticos axilares | |
| Estádio 2B |  | T2, N1, M0 | O tumor é maior que 20 mm, menor que 50 mm e espalhou-se para um a três gânglios linfáticos axilares. |
 | T3, N0, M0 | O tumor é maior que 50 mm, mas ainda não se espalhou para os gânglios linfáticos axilares. | |
| Estádio 3A |  | T0, T1, T2 ou T3, N2, M0 | Cancro de qualquer tamanho que se espalhou para 4 a 9 gânglios linfáticos axilares, mas não para outras partes do corpo; ou |
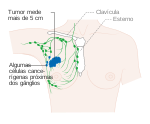 | T3, N1, M0 | Pode também corresponder a um tumor maior que 50 mm que se espalhou para um a três gânglios linfáticos | |
| Estádio 3B |  | T4; N0, N1 ou N2; M0 | O tumor espalhou-se para a parede torácica ou causou inflamação ou ulceração da mama ou foi diagnosticado carcinoma inflamatório da mama. Pode ou não ter-se espalhado para os gânglios linfáticos por baixo do braço, mas ainda não existem metástases. |
| Estádio 3C | qualquer T, N3, M0 | O tumor de qualquer tamanho que ainda não tenha metástases mas que se tenha espalhado para 10 ou mais gânglios linfáticos axilares ou para os gânglios do grupo N3. | |
| Estádio 4 (metastático) |  | qualquer T, qualquer N, M1 | Tumor de qualquer tamanho que se tenha espalhado para outros órgãos, como os ossos, pulmões, cérebro, fígado, gânglios linfáticos distantes ou parede torácica (). |
Prevenção
Estilo de vida
O risco de cancro da mama pode ser diminuído mantendo um peso saudável, limitando a ingestão de álcool, amamentando os filhos e praticando atividade física regular e um estilo de vida ativo. O conjunto destas medidas pode prevenir até 42% dos cancros da mama.[91] O exercício físico moderado, como a caminhada vigorosa, apresenta benefícios em todas as faixas etárias, incluindo em mulheres após a menopausa.[91][92] O consumo de ácidos gordos polinsaturados ómega-3 e o consumo significativo de alimentos à base de soja aparenta diminuir o risco de cancro da mama.[93][94] Para além disso, as medidas que encorajam a atividade física regular e a diminuição da obesidade têm também outros benefícios, como a diminuição do risco de doenças cardiovasculares e diabetes.[28]
Mastectomia profilática
A mastectomia profilática, ou preventiva, é a remoção de ambas as mamas anterior a qualquer diagnóstico de cancro ou ao aparecimento de nódulos ou lesões suspeitas. Esta medida pode ser considerada em pessoas com mutações nos genes BRCA1 e BRCA2, as quais estão associadas a um risco muito maior de um eventual diagnóstico de cancro da mama.[95][96] Não há evidências suficientemente fortes que apoiem este procedimento em outras pessoas para além daquelas em maior risco. A realização de testes genéticos BRCA é recomendada apenas a pessoas com elevado risco familiar e após aconselhamento. Não é recomendada a sua realização de rotina, uma vez que existem muitas formas diferentes de alterações nos genes BRCA, desde polimorfismos inofensivos até mutações perigosas, e o efeito de maior parte destas alterações ainda é incerto. Os testes em pessoas de baixo risco têm uma elevada probabilidade de apresentar falsos positivos. Também não é ainda claro se a remoção da segunda mama em pessoas que tiveram cancro na outra tem benefícios.[97][98]
Fármacos
Os moduladores seletivos do receptor de estrógeno, como o tamoxifeno, diminuem o risco de cancro da mama, mas aumentam o risco de tromboembolia e cancro endometrial.[99][100] É uma opção disponível para prevenção do cancro da mama em mulheres de elevado risco, mas não é recomendada a sua utilização em mulheres de risco moderado.[101] O benefício destes medicamentos na prevenção do cancro da mama prolonga-se por cinco anos após a interrupção do tratamento.[100]
Rastreio
Quando os tumores são suficientemente grandes para serem sentidos através de palpação, é provável que já se tenham espalhado para além da mama. Os exames de rastreio permitem detectar a presença de cancro antes de haver manifestação de sinais ou sintomas e quando o tumor ainda se encontra restrito na mama. Quando mais cedo é detectado um cancro e iniciado o tratamento, melhor é o prognóstico.[102][103] As direções de saúde de muitos países recomendam o rastreio regular de cancro da mama. Nos Estados Unidos, é recomendada a realização de uma mamografia a cada dois anos em mulheres entre os 50 e os 74 anos de idade.[12] Na União Europeia, a maior parte dos países recomenda a realização de mamografias de rastreio a cada dois anos entre os 50 e 69 anos.[104] As mesmas recomendações alertam que a realização de mamografias em intervalos menores aumenta o risco de cancro da mama induzido por radiação, para além de ansiedade e cirurgias desnecessárias.[105]
A mamografia usa raios-x para examinar a mama e detectar eventuais formações ou nódulos suspeitos. Durante o exame, a mama é comprimida e um técnico obtém imagens de vários ângulos. Uma mamografia geral obtém imagens da totalidade da mama, enquanto uma mamografia de diagnóstico se foca numa área suspeita ou num nódulo específico.[106] Quando se observam sinais suspeitos, a mulher é geralmente convocada para uma segunda mamografia ou para a realização de uma biópsia. O prazo entre as duas mamografias pode ser de até seis meses, de modo a poder observar um eventual crescimento da lesão suspeita.[107] Embora a espera possa causar ansiedade, a maior parte das lesões suspeitas acabam por se revelar falsos positivos.[108] Um em cada quatro cancros detetados por mamografia são pseudocancros, o que corresponde a um sobrediagnóstico de 25%.[109][110] Ainda se desconhece se a ressonância magnética é um método que apresenta mais benefícios ou malefícios quando comparado com a mamografia convencional.[111]
Os exames de mama podem ser realizados pela própria mulher (autoexame de mama) ou por um profissional de saúde (exame clínico) e envolvem a apalpação da mama para sentir a presença de nódulos ou outras situações suspeitas.[102] No entanto, apesar de bastante recomendados no passado, as evidências atuais não apoiam a eficácia dos autoexames de mama, uma vez que no momento em que um nódulo seja suficientemente grande para ser sentido na palpação, é provável que já se tenha vindo a desenvolver ao longo de vários anos e que em breve tenha uma dimensão que permita ser descoberto mesmo sem exame.[12][112][113] O autoexame de mama não está associado a uma diminuição da mortalidade, estando ao mesmo tempo associado a malefícios em termos de falsos positivos e aumento do número de biopsias desnecessárias.[114] Atualmente, muitas organizações científicas, entre as quais a Organização Mundial de Saúde, não recomendam a utilização do autoexame da mama como método eficaz de rastreio em mulheres de baixo risco e tem vindo a ser removido das recomendações das autoridades de saúde pública de vários países.[115][116][117] No entanto, a recomendação da realização de auto-exame da mama mantém-se no caso das mulheres de alto risco (portadoras de mutações nos genes BRCA1 e BRCA2).[118]
Em 2013, a Colaboração Cochrane concluiu que as evidências de melhor qualidade não demonstram que a mamografia de rastreio diminua a mortalidade específica do cancro da mama nem a mortalidade por qualquer causa.[10] Quando incluídos também os ensaios com menor rigor, verifica-se uma redução da mortalidade por cancro da mama de 0,05% (diminuição de 1 em 2000 mortes por cancro da mama ao longo de dez anos ou uma diminuição relativa de 15%).[10] Por outro lado, o rastreio ao longo de dez anos aumenta em 30% o número de sobre-diagnósticos e sobre-tratamentos (3 a 14 por 1000) e mais de metade das pessoas terão pelo menos um exame falso positivo.[10][119][120] Isto tem levado a que tenham vindo a ser questionados os benefícios da mamografia de rastreio.[10][120]
Tratamento
O tratamento do cancro da mama depende de vários factores, incluindo o estágio do cancro e a idade da pessoa. À medida que o prognóstico é gradualmente menos favorável e o risco de nova ocorrência maior, são utilizados tratamentos cada vez mais agressivos.[121] O cancro da mama é geralmente tratado com cirurgia, a qual pode ser seguida por quimioterapia ou radioterapia. É preferível uma abordagem multidisciplinar.[122] Os cancros com recetores de hormonas positivos são muitas vezes tratados com terapia de bloqueio hormonal ao longo de vários anos. Em alguns casos de cancro metastático ou outros estádios avançados podem ser usados anticorpos monoclonais ou outros tratamentos imunoterapêuticos.[123]
Cirurgia
A cirurgia envolve a remoção física do tumor, geralmente com algum do tecido adjacente. Durante a cirurgia podem ser realizadas biopsias aos gânglios linfáticos. Entre as cirurgias comuns estão:[121]
- Mastectomia: Remoção completa da mama;
- Quadrantectomia: Remoção de um quarto da mama;
- Lumpectomia: Remoção de uma pequena parte da mama.
Uma vez removido o tumor, é possível realizar uma cirurgia de reconstrução de mama para melhorar a aparência estética do zona tratada. Em alternativa, algumas mulheres usam próteses mamárias para simular a mama por baixo da roupa.[121]
Radioterapia
A radioterapia é geralmente realizada após a intervenção cirúrgica. Esta terapia consiste na emissão de radiação ionizante para a região onde se formou o tumor e gânglios linfáticos regionais, com o objetivo de destruir eventuais células tumorais microscópicas que possam ter restado.[124][125] A radioterapia pode ser externa ou interna. Em alguns casos, pode ser realizada em simultâneo com a operação (radioterapia interoperatória). A radioterapia interoperatória dirigida aparenta ter o mesmo grau de eficácia, após quatro anos, que várias semanas de radioterapia externa.[126]
Medicação
Os fármacos usados após e em conjunto com a cirurgia são denominados terapia adjuvante. A quimioterapia ou outros tipos de terapia usados antes da cirurgia são denominados terapia neoadjuvante. Existem atualmente três principais grupos de medicamentos usados para o tratamento adjuvante do cancro da mama: agentes de bloqueio hormonal, quimioterapia e anticorpos monoclonais.[121]
Hormonoterapia
Alguns cancros da mama necessitam de determinadas hormonas para continuar a crescer. Este tipo de cancro pode ser identificado pela presença na sua superfície de recetores hormonais, como recetores de estrogénio (ER+) e de progesterona (PR+). Os cancros ER+ podem ser tratados com fármacos que bloqueiam esses recetores, como o tamoxifeno, ou que bloqueiam a produção de estrogénio com um inibidor da aromatase, como o anastrozol. O uso de tamoxifeno é recomendado ao longo de um período de dez anos.[127][128] Os inibidores da aromatase são adequados apenas para mulheres após a menopausa, grupo em que aparentam ser superiores ao tamoxifeno.[129] Isto acontece porque a aromatase ativa nas mulheres pós-menopausa é diferente da forma prevalente nas mulheres pré-menopausa, pelo que estes agentes são ineficazes em inibir a arometase predominante antes da menopausa.[130]
Quimioterapia
A quimioterapia é predominantemente usada em casos de cancro da mama entre os estádios 2 e 4, sendo particularmente benéfico na doença com recetores de estrogénio negativos (ER-). Os medicamentos de quimioterapia são administrados em combinações e geralmente ao longo de um período de 3-6 meses. Um dos regimes mais comuns, denominado "AC", combina ciclofosfamida com doxorrubicina. Por vezes é acrescentado uma taxina como o docetaxel, sendo então denominado "CAT". Outro tratamento comum é o regime de ciclofosfamida, metotrexato e 5-fluorouracil (CMF). No entanto, este regime é mais nocivo para os ovários do que os regimes baseados em antraciclinas. O regime mais usado atualmente é a combinação de 5-fl-epirubicina-ciclofosfamida. Os agentes alquilantes como a ciclofosfamida são bastante tóxicos para o ovário, pelo que são geralmente usados agonistas da GnRH para bloquear o ovário e preservar a sua função.[131]
Imunoterapia
O trastuzumab é um anticorpo monoclonal do HER2 – um recetor celular que é particularmente ativo em células do cancro da mama. Este fármaco melhorou a sobrevivência a cinco anos sem novas ocorrências da doença para cerca de 87% (sobrevivência geral de 95%) em cancros da mama HER2+ de estádio 1-3-[132] Quando estimulado por determinados fatores de crescimento, o HER2 causa crescimento e divisão celular, mas na ausência desses fatores a célula normalmente para de crescer. Entre 25% e 30% dos cancros da mama superexpressam o gene HER2 ou o seu produto proteico.[133] Esta superexpressão do HER2 no cancro da mama está associada ao aumento da recorrência da doença e prognóstico menos favorável. Quando o trastuzumab se liga ao HER2 nas células cancerosas que superexperssam o recetor, o medicamento impede que os fatores de crescimento sejam capazes de se ligar e estimular os recetores, bloqueando assim o crescimento das células cancerosas. No entanto, o trastuzumab é significativamente dispendioso e pode causar efeitos secundários graves, com cerca de 2% das pessoas tratadas a anifestar problemas cardíacos significativos.[134]
Prognóstico
O prognóstico é geralmente dado para a probabilidade de sobrevivência livre de progressão (progression free survival ou PFS) ou sobrevivência livre de doença (disease free survival ou DFS). Estas probabilidades baseiam-se na experiência com pacientes de cancro da mama com classificações idênticas. Um prognóstico é uma estimativa, uma vez que pacientes com a mesma classificação sobrevivem diferentes períodos de tempo e as classifcações nem sempre são precisas. A sobrevivência é geralmente determinada na forma de um número médio de meses ou anos que metade dos pacientes sobreviverá, ou a percentagem de pacientes que continuarão vivos após 1, 5, 15 e 20 anos. O prognóstico é importante para tomar decisões durante o tratamento, uma vez que aos pacientes com melhor prognóstico são oferecidos tratamentos menos invasivos, como a lumpectomia, radioterapia e hormonoterapia, enquanto que aos pacientes com pior prognóstico são oferecidos tratamentos mais agressivos, como mastectomia extensa e quimioterapia.[135]
Fatores prognósticos
O estádio do cancro da mama é o componente mais importante dos sistemas de classificação do cancro da mama, uma vez que é aquele que tem maior influência no prognóstico. O estadiamento leva em consideração o temanho, envolvimento local, estado dos gânglios linfáticos e se existem ou não metástases. Quando mais avançado o estádio do diagnóstico, mais desfavorável é o prognóstico. A invasividade e agressividade das células cancerosas fazem aumentar o estádio, enquanto que a presença de áreas sem cancro e comportamento celular próximo do normal (grau) fazem diminuir o estádio. O tamanho não é um fator a não ser que o cancro seja invasivo.[nota 1][136]
- Os cancros de estádio 1 e os carcinomas ductais e lobulares in situ têm um excelente prognóstico e são geralmente tratados com lumpectomia e, por vezes, radioterapia.[137] Os cancros HER2+ são geralmente tratados com um regime de trastuzumab.[138] A quimioterapia é pouco comum em outro tipo de cancros de estádio 1.
- Os cancros de estádio 2 e 3 apresentam um prognóstico progressivamente desfavorável e maior risco de recorrência. São geralmente tratados com cirurgia (lumpectomia ou mastectomia com ou sem remoção dos gânglios linfáticos), quimioterapia (com trastuzumab em cancros HER2+) e por vezes radioterapia (particularmente em tumores de grande dimensão, múltiplos nódulos positivos ou lumpectomia).[136]
- O cancro metastático de estádio 4 apresenta um prognóstico pouco favorável e é tratado com várias combinações de cirurgia, radioterapia, quimioterapia e terapias dirigidas. A taxa de sobrevivência aos dez anos é de 5% sem tratamento e 10% com tratamento adequado.[136]
As mulheres mais jovens tendem a apresentar pior prognóstico do que as mulheres pós-menopausa devido a diversos fatores. As suas mamas podem sofrer alterações devido ao ciclo menstrual ou podem encontrar-se a amamentar crianças, o que torna mais difícil à mulher aperceber-se de alterações suspeitas. Geralmente, quando o cancro é diagnosticado em mulheres jovens, já se encontra num estádio mais avançado. Podem também existir fatores biológicos que aumentam o risco de recorrência em mulheres mais jovens.[139]
A elevada densidade da mama em mamografia, que é um marcador de risco para desenvolver cancro da mama, pode não significar um aumento do risco de morte entre pacientes de cancro.[140]
Uma vez que o cancro da mama em homens é geralmente detetado em estádios avançados, o prognóstico é muitas vezes pouco favorável.[141]
Contraceção
Em sobreviventes do cancro da mama, a primeira escolha de contraceção devem ser métodos não hormonais. Os métodos baseados em progestógenos, como o Depo Provera, dispositivo intrauterino com progesterona ou pílula exclusivamente de progestágeno possivelmante aumentam o risco de recorrência do cancro, embora essa possibilidade ainda esteja pouco estudada. No entanto, podem ser usados se os benefícios forem superiores ao possível risco.[142]
Menopausa
Em sobreviventes do cancro da mama, recomenda-se considerar primeiro opções não hormonais para os efeitos da menopausa, como os bifosfonatos ou moduladores seletivos do receptor de estrógeno para a osteoporose, ou estrógenos vaginais para sintomas locais. Os estudos observacionais de terapêutica de substituição hormonal após o cancro da mama são na generalidade positivos. Caso seja necessária substituição hormonal, a terapia exclusiva de estrogénio ou terapia de estrogénio com um dispositivo intrauterino de progestágeno podem ser opções mais seguras do que a terapia sistémica combinada.[143]
Aspetos psicológicos
O diagnóstico, sintomas e tratamento do cancro tem um impacto emocional profundo. O cancro e o tratamento podem provocar alterações na aparência da pessoa, como perda de cabelo, ganho ou perda de peso, cicatrizes cirúrgicas, exantemas, perda de uma mama e cansaço que pode retirar a motivação para realizar atividades de que anteriormente se gostava. Muitos hospitais estão associados a grupos de apoio para o cancro, que proporcionam ajuda e aconselhamento aos pacientes. Muitas das alterações desaparecem ou melhoram após o tratamento. A cosmética e a cirurgia reconstrutiva podem ajudar as pessoas a lidar melhor com as alterações físicas. O diálogo com outros pacientes, sobreviventes de cancro ou grupos de apoio ajuda a aceitar melhor as alterações com o corpo. A atividade física oferece energia e ajuda a pessoa a sentir-se melhor durante o tratamento.[144]
Nem todos os pacientes vivem a doença da mesma maneira. Alguns fatores, como a idade, podem ter um impacto significativo na forma como a pessoa reage a um diagnóstico de cancro da mama. As mulheres jovens têm muitas vezes que se confrontar com a eventualidade de uma menopausa precoce induzida por muitos dos regimes de quimioterapia usados no tratamento, particularmente aqueles que usam hormonas que suprimem a função dos ovários.[145] Muitas pessoas com cancro apresentam sintomas de ansiedade, espoletada pela incerteza do diagnóstico, medo da morte pela doença, recidivas ou receio do tratamento. A ansiedade por agravar os efeitos secundários do tratamento, como a fadiga, tornar a pessoa dependente de outrem ou alterar a relação com a família e amigos. A ansiedade pode ser gerida com aconselhamento psicológico, técnicas de relaxamento ou medicação.[146]
Epidemiologia
O cancro da mama é o segundo cancro mais comum em todo o mundo e o cancro mais comum entre mulheres, tanto em países desenvolvidos como em países em vias de desenvolvimento. Estima-se que em 2012 tenham sido diagnosticados 1,67 milhões de novos casos, o que corresponde a 25% de todos os diagnósticos de cancro. A incidência entre as várias regiões do mundo varia significativamente, desde 19,3 casos por 100 000 habitantes na África Oriental até 89,7 na Europa Ocidental.[148] Globalmente, o cancro da mama é a quinta causa de morte por cancro, tendo sido o responsável por 522 000 mortes em 2012. Em países desenvolvidos, é a segunda causa de morte por cancro (198 000 mortes, ou 15,4%), apenas atrás do cancro do pulmão. A mortalidade varia entre 6 mortes por cada 100 000 pessoas no Extremo Oriente e 20 por cada 100 000 na África Ocidental. A amplitude da mortalidade entre as regiões do mundo é menor do que a da incidência devido à melhor sobrevivência que se regista em países desenvolvidos.[149] As baixas taxas de sobrevivência nos países em desenvolvimento são causadas pela inexistência de programas de rastreio precoce e falta de diagnóstico e instalações adequadas.[148]
No Brasil, o cancro da mama é o tipo de cancro mais comum entre as mulheres, seguido pelos cancros do colo do útero, cólon e reto, pulmão e estômago. Apesar de não ser o cancro com maior mortalidade, o cancro da mama é uma das causas mais comuns de mortes por cancro em mulheres devido à grande quantidade de casos.[150] Em 2003, São Paulo teve a maior quantidade de novos casos diagnosticados, com 94 por cada 100 000 habitantes, seguida pelo Distrito Federal com 86,1/100 000 e Porto Alegre com 66,5/100 000.[151] Um dos motivos possíveis para esse elevado número de casos nas capitais é o elevado consumo de álcool e tabaco e a maior exposição a estimulantes hormonais femininos e a pesticidas nos alimentos.[152]
Em Portugal, o cancro da mama é o tipo de tumor maligno mais comum entre as mulheres, seguido pelo do cólon, tiroide e estômago, e o segundo mais comum entre a população em geral. Em 2009, a taxa de incidência de tumores malignos da mama entre a população em geral foi de 57,94 casos por 100 000 habitantes e entre o sexo feminino de 110,12 casos por 100 000 habitantes.[nota 2] Em 2012, os tumores malignos da mama femininos foram responsável por 1 663 óbitos, correspondentes a uma taxa de mortalidade de 31,8 por cada 100 000 mulheres (taxa padronizada: 19,60).[153]
História
Embora o cancro da mama seja conhecido desde a Antiguidade, até ao século XIX era pouco comum. A gravidez e amamentação precoces provavelmente contribuíram para a reduzida prevalência de cancro entre as mulheres que sobreviviam até à meia idade e a maior parte das mulheres morria demasiadamente cedo para desenvolver cancro. No entanto, a melhoria significativa da higiene e do controlo de doenças infeciosas nesse século provocou um aumento significativo da esperança de vida e, por sua vez, o aumento do número de casos.[154]
Devido à sua visibilidade, o cancro da mama é a forma de cancro que mais frequentemente é descrita em documentos antigos. Uma vez que as autópsias eram pouco comuns, os cancros dos órgãos internos raramente eram observados na medicina da antiguidade. No entanto, o cancro da mama podia ser facilmente sentido através da pele e, em estádios avançados, muitas vezes desenvolvia lesões, tornava-se necrótico e ulcerava pela pele.[155] A mais antiga descrição do cancro da mama data da VI dinastia egípcia[156] O primeiro registo de uma mastectomia data de 548 d.C., quando foi proposta por Aécio de Amida à imperatriz Teodora.[155] A medicina primitiva, desde a Antiguidade grega até ao século XVII, baseava-se no humorismo e acreditava que o cancro da mama fosse causado por desiquilíbrios nos fluidos essenciais que controlavam o corpo, especialmente pelo excesso de bílis negra.[157] Muitos pacientes viam o cancro como castigo divino.[158] No século XVIII começaram a ser propostas várias explicações, desde a falta de atividade sexual até ao excesso de atividade sexual, lesões físicas no peito, coagulação de leite na mama e várias formas de bloqueios linfáticos, quer internos quer devido a vestuário muito apertado.[154][157]
Só quando no século XVII se começou a compreender o sistema circulatório é que os médicos puderam associar a disseminação do cancro da mama aos gânglios linfáticos na axila. O cirurgião francês Jean-Louis Petit (1674–1750) e mais tarde o escocês Benjamin Bell (1749–1806) foram os primeiros a remover com sucesso os gânglios linfáticos, tecido mamário e o músculo adjacente. O seu trabalho foi continuado William Stewart Halsted, que começou a realizar mastectomias radicais em 1882, apoiado pelo progresso na tecnologia de cirurgia, como a asepsia e a anestesia. Esta técnica radical muitas vezes envolvia remover ambas as mamas, os gânglios linfáticos e os músculos adjacentes. Isto provocava muitas vezes dor e incapacidade a longo prazo, mas era visto como um mal necessário para impedir o cancro de voltar a ocorre.[159] Antes do aparecimento das mastectomias radicais, a sobrevivência a 10 anos era de apenas 10%, tendo aumentado para 50%.[160] Com base no trabalho de Halsted, Jerome Urban promoveu cirurgias ainda mais radicais com remoção de maior quantidade de tecido. Esta técnica continuou a ser usada até 1963, quando se demonstrou que as taxas de sobrevivência a dez anos eram idênticas à mastectomia de Halsted.[159] Os sistemas de classificação em estádios para o cancro da mama começaram a ser desenvolvidos nas décadas de 1920 e 1930.[159]
Embora as mastectomias radicais se tenham mantido como o procedimento padrão na América do Norte até à década de 1970, desde a década de 1950 que na Europa começaram a ser adotadas medidas que conservavam o máximo possível de tecido, complementadas por radioterapia.[159] Uma das explicações para esta diferença está na proporção entre sexos na época: enquanto na América do Norte as mulheres cirurgiãs representavam menos de 1% da classe, no corpo clínico oncológico de alguns hospitais da Europa metade da equipa era constituída por mulheres.[159] Durante a década de 1970, a nova compreensão sobre as metástases permitiu ver o cancro como uma doença não só localizada, mas também sistémica, tendo sido desenvolvidos novos procedimentos que se provou terem a mesma eficácia, como a quimioterapia moderna.[161] Na década de 1980, vários estudos não controlados sugeriram que complementar a radioterapia com transplantes de medula óssea poderia ser eficaz no tratamento de cancros duros, o que mais tarde se veio a demonstrar ser falso e especulativo. No entanto, entre os finais da década de 1980 e 1998 foram realizados milhares de transplantes, os quais têm diversos efeitos adversos graves e taxas de mortalidade de 3 a 15%. Em 2002, concluiu-se que a terapêutica hormonal de substituição aumentava significativamente o risco de cancro da mama.[162][163]
Sociedade e cultura
Até ao início do século XX, o cancro da mama era visto como uma fatalidade sem cura. Pouco podia ser feito com as técnicas cirúrgicas primitivas, pelo que as mulheres tendiam a sofrer em silêncio e vergonha, em vez de procurar ajuda. Quando o progresso na cirurgia melhorou a sobrevivência do cancro, as mulheres começaram a consciencializar-se da doença e da possibilidade de tratamento. Uma das primeiras campanhas organizadas de sensibilização da opinião pública – Women's Field Army – teve lugar nos Estados Unidos entre as décadas de 1930 e 1940. Em 1952 surgiu o primeiro grupo de ajuda mútua, denominado "Reach to Recovery", que promovia o contacto entre pacientes e sobreviventes de cancro.[164]
Os movimentos de apoio e sensibilização para o cancro da mama das décadas de 1980 e 1990 surgiram a partir dos movimentos feministas e movimentos para a saúde da mulher do século XX.[165] Esta série de campanhas políticas e educativas, em parte inspirada pela eficácia das campanhas de sensibilização para a SIDA, contribuiu para aceitação generalizada da importância de uma segunda opinião antes de uma cirurgia, a opção por por cirurgias menos invasivas, a vulgarização de grupos de apoio e outros progressos nos cuidados ao paciente.[166]
Laço cor-de-rosa
O laço cor-de-rosa é o símbolo mais proeminente do movimento de sensibilização para o cancro da mama. Os laços, que podem ser produzidos sem grandes custos, são frequentemente vendidos para angariação de fundos. Podem ser usados para homenagear as pessoas a quem foi diagnosticado cancro ou para identificar produtos que o fabricante pretenda vender a consumidores sensíveis para a questão do cancro da mama.[167] O laço cor-de-rosa está associado à generosidade individual, fé no progresso científico e a uma atitude proativa, encorajando os consumidores a focar-se na perspetiva positiva de uma eventual cura para o cancro.[168]
Por outro lado, envergar o laço cor-de-rosa é muitas vezes criticado pelos que consideram esta prática um ativismo de sofá sem qualquer efeito prático positivo. Também tem sido criticado como hipocrisia, uma vez que algumas das mesmas pessoas, empresas ou organizações que usam o laço cor de rosa para demonstrar solidariedade com as mulheres com cancro, ao mesmo tempo opõem-se a medidas realmente eficazes, como direitos dos pacientes e medidas de combate à poluição atmosférica.[169][170] Os críticos argumentam que a natureza otimista dos laços cor-de-rosa e o consumo de produtos cor-de-rosa distrai a sociedade da ausência de progresso na prevenção e cura da doença.[171] O laço é também criticado por reforçar os estereótipos de género e objetificar a mulher e os seus seios.[172]
Impacto económico
Em comparação com outras doenças ou outros cancros, o cancro da mama recebe uma fatia relativamente maior de recursos e atenção das entidades públicas[173] e maior cobertura mediática em relação a outros cancros de igual prevalência.[174] Uma das consequências desta elevada visibilidade é que por vezes os resultados estatísticos podem ser interpretados de forma incorreta. Por exemplo, a alegação de que uma em cada oito mulheres será diagnosticada com cancro da mama ao longo da vida depende da assunção irrealista de que nenhuma mulher morrerá devido a outra doença antes dos 95 anos.[175] Em 2009, o custo económico do cancro na União Europeia foi de 126 mil milhões de euros, dos quais 12% (15 mil milhões) se destinaram ao cancro da mama. Os custos diretos de tratamento correspondem a 40% destes valores.[176]
Na gravidez
O cancro da mama associado à gravidez é aquele que é diagnosticado durante a gravidez ou no primeiro ano pós parto. É a neoplasia mais comum durante a gestação e é cada vez mais frequente à medida que a idade média da maternidade é cada vez mais avançada. A maioria são carcinomas ductais invasivos (80-100%), pouco diferenciados, de grandes dimensões, com invasão linfática e vascular e negativos para os recetores de estrogénio. A maioria (53,3%) dos casos é diagnosticada no pós-parto. O cancro da mama associado à gravidez ocorre numa grávida em cada 3000-10000 e corresponde a entre 0,2% e 3,8% de todos os diagnósticos de cancro da mama.[177]
O diagnóstico de cancro durante a gravidez é mais difícil devido ao aumento de tamanho das glândulas mamárias induzido pelo estado hormonal. Na maioria das grávidas a mamografia revela uma glândula mamária muito densa, heterogénea e nodular, o que diminui significativamente a sensibilidade deste exame. Isto faz com que os nódulos sejam frequentemente subvalorizados, atribuídos a alterações benignas ou a desconfortos normais da gravidez,[177][178] e faz com o cancro seja geralmente descoberto num estádio mais avançado. Algumas técnicas de imagiologia, como a ressonância magnética, ecografia e mamografia com proteção do feto são seguras durante a gravidez, enquanto outras, como a TEP, não o são.[179]
O tratamento é geralmente o mesmo que para mulheres não grávidas. Em alguns casos, o tratamento é adiado para depois do parto, sobretudo se o cancro é detetado numa fase avançada da gravidez. As induções de parto para dar início ao tratamento são pouco comuns. A cirurgia é geralmente considerada segura, embora se evite a radioterapia. Muitos fármacos usados em quimioterapia não são administrados durante o primeiro trimestre devido ao risco de doenças congénitas e aborto espontâneo. A reazliação de um aborto não é necessária e não aumenta a probabilidade de cura ou sobrevivência da mãe. No pós-parto, a radioterapia pode interferir com a capacidade de amamentação da mãe, uma vez que diminui a capacidade de produção de leite e aumenta o risco de mastite, e os fármacos de quimioterapia podem passar para o bebé através do leite.[179]
Investigação
Nos últimos anos têm sido aprovados diversos medicamentos inovadores e estão atualmente a ser investigados novos métodos de diagnóstico e tratamento para o cancro da mama.[180] Entre os novos meios de rastreio e diagnóstico estão a tomossíntese mamária, uma técnica tomográfica de baixa radiação que capta imagens de vários ângulos em redor da mama e as sintetiza num modelo tridimensional. Estão também a ser investigadas formas de personalizar o rastreio de acordo com o risco de cada mulher, com o objetivo de diminuir o número de falsos positivos.[180] A análise genómica tem permitido aprofundar o estudo da diversidade molecular do cancro da mama e pode permitir identificar ainda mais subtipos de cancro, o que poderá levar ao desenvolvimento de terapias que têm como alvo as alterações genéticas desses subtipos.[180]
Medicamentos inovadores
Entre as novas opções de medicamentos recentemente aprovados que podem ser usados com o tratamento hormonal de cancros do tipo ER+ e PR+ em estado avançado ou metastático estão o palbociclib, ribociclib e everolímus.[180] O abemaciclib pode ser administrado em conjunto com terapia hormonal ou de forma isolada após o tratamento com terapia horminal em mulheres com canco ER+ HER- avançado ou metastático.[180][181] O alpelisib pode ser usado em conjunto com terapia hormonal no tratamento de cancros HR+ e HER- com origem em mutações do gene PIK3CA.[180][182][183]
Estão também disponíveis novas opções de tratamento para os cancros HER+. O trastuzumab e o pertuzumab podem ser usados em conjunto com quimioterapia tanto em estádios iniciais como avançados.[180][184] O trastuzumab pode também ser usado para prevenir uma recidiva em pessoas com cancro HER+ em estádio inicial.[180] O trastuzumab emtansina pode ser usado em cancros HER+ em estádio avançado.[180] O lapatinib pode ser usado no tratamento de cancro HER+ metastático.[180][185][186] O maleato de neratinib pode ser administrado em estádios iniciais de cancros HER+ e também em associação com capecitabina em alguns pacientes com doença avançada ou metastática.[180][187] Em 2020 foi aprovado o uso de tucatinib em associação com trastuzumab e capecitabina para o tratamento de cancro HER+ metastático ou que não possa ser removido com cirurgia.[180] Estão também a ser estudados vários medicamentos que consigam penetrar a barreira hematoencefálica para o tratamento de metástases no cérebro de cancros HER+.[180][188]
Estão também a ser estudados vários tratamentos para o cancro da mama triplo negativo, o tipo mais difícil de tratar por não responder a terapias hormonais.[180] Em 2020 foi aprovado o uso de sacituzumab govitecan-zhiy (Trodelvy) para o tratamento de cancro triplo negativo metastático.[180][189] Os inibidores PARP bloqueiam uma proteína usada parar reparar danos ao AN durante a divisão celular. Estes medicamentos, que incluem o olaparib (Lynparza) e o talazoparib (Talzenna), atuam no cancro triplo negativo causado por determinadas mutações do gene BRCA ou outras alterações que causam defeitos na reparação do ADN.[180][190][191]
Os medicamentos imunoterapêuticos têm demonstrado ser promissores num pequeno número de cancros da mama, em particular nos triplo negativos. Alguns dados sugerem que os pacientes podem ter maior probabilidade de responder de forma positiva à imunoterapia quando os tumores expressam a proteína PD-L1 ou apresentam elevado número de mutações.[180] Os cientistas têm também estudado se a associação de vários medicamentos com imunoterapia é mais eficaz do que apenas a imunoterapia.[180] O atezolizumab (Tecentriq) foi aprovado para uso em associação com quimioterapia em pacientes com cancro triplo negativo metastático que expressam a proteína PD-L1.[180][192] Estão também a ser estudados medicamentos que bloqueiam os receptores de androgénio ou que previnam a produção de androgénio em cancros triplo negativos que expressem esses receptores.[180]
Dispositivo inteligentes
Vários dispositivos foram desenvolvidos para monitorar pessoas com histórico familiar predispostas ao câncer, cânceres recorrentes e pacientes assintomáticos. Os pesquisadores desenvolveram uma roupa inteligente com tecnologia de miniaturização que permite o sistema de detecção do 'SmartBra'(Sutiã inteligente), para que ainda seja confortável de usar e quase imperceptível. Se o sistema detectar uma massa suspeita de células, ele alertará o usuário para que ele possa agendar uma consulta com um especialista. O dispositivo detecta câncer nos estágios iniciais e pode ser usado para prevenção de câncer.[193] A tecnologia emite ondas de ultra-som - como aquelas empregadas no ultra-som focalizado de alta intensidade (HIFU) e no ultra-som pulsado de baixa intensidade (LIPU) - para realizar exames de ecografia de células potencialmente cancerígenas. Sensores piezoelétricos são usados para gerar ondas de ultra-som.[194]
Notas
- ↑ Por exemplo, um carcinoma ductal in situ que envolva toda a mama continua a ser estádio zero e a ter um excelente prognóstico, com sobrevivência livre de doença de cerca de 98%.
- ↑ Tumores malignos. Taxa de incidência bruta em ambos os sexos: 57,94 por 100 000 habitantes. Taxa de incidência padronizada (população europeia) em ambos os sexos: 47,23 casos por 100 000 habitantes. Taxa de incidência bruta no sexo feminino: 110,12 por 100 000 mulheres. Taxa de incidência padronizada (população europeia) no sexo feminino: 87,58 por 100 000 mulheres.[153]
Referências
- ↑ a b c d e f g h i National Cancer Insitute (2014). «Breast Cancer Treatment». Consultado em 29 de junho de 2014
- ↑ a b c d e f International Agency for Research on Cancer (2014). World Cancer Report 2014. [S.l.]: Organização Mundial de Saúde. pp. Capítulo 5.2. ISBN 92-832-0429-8
- ↑ «Klinefelter Syndrome». Eunice Kennedy Shriver National Institute of Child Health and Human Development. 24 de maio de 2007. Arquivado do original em 27 de novembro de 2012
- ↑ «SEER Stat Fact Sheets: Breast Cancer». NCI. Consultado em 18 de junho de 2014. Cópia arquivada em 3 de julho de 2014
- ↑ «Cancer Survival in England: Patients Diagnosed 2007–2011 and Followed up to 2012» (PDF). Office for National Statistics. 29 de outubro de 2013. Consultado em 29 de junho de 2014. Cópia arquivada (PDF) em 29 de novembro de 2014
- ↑ GBD 2015 Disease and Injury Incidence and Prevalence, Collaborators. (8 de outubro de 2016). «Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990–2015: a systematic analysis for the Global Burden of Disease Study 2015.». Lancet. 388 (10053): 1545–1602. PMC 5055577
 . PMID 27733282. doi:10.1016/S0140-6736(16)31678-6
. PMID 27733282. doi:10.1016/S0140-6736(16)31678-6 - ↑ GBD 2015 Mortality and Causes of Death, Collaborators. (8 de outubro de 2016). «Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980–2015: a systematic analysis for the Global Burden of Disease Study 2015.». Lancet. 388 (10053): 1459–1544. PMC 5388903
 . PMID 27733281. doi:10.1016/s0140-6736(16)31012-1
. PMID 27733281. doi:10.1016/s0140-6736(16)31012-1 - ↑ National Cancer Institute (2014). «Breast Cancer». Consultado em 29 de junho de 2014
- ↑ Saunders, Christobel; Jassal, Sunil (2009). Breast cancer. Oxford: Oxford University Press. p. Capítulo 13. ISBN 978-0-19-955869-8
- ↑ a b c d e Gøtzsche, PC; Jørgensen KJ (2013). «Screening for breast cancer with mammography.». The Cochrane database of systematic reviews. 6: CD001877. PMID 23737396. doi:10.1002/14651858.CD001877.pub5
- ↑ Nelson, HD; Tyne, K; Naik, A; Bougatsos, C; Chan, B; Nygren, P; Humphrey, L (2009). «Screening for Breast Cancer: Systematic Evidence Review Update for the US Preventive Services Task Force». PMID 20722173
- ↑ a b c US Preventative Services Task Force (2009). «Screening for Breast Cancer». Consultado em 24 de dezembro de 2012
- ↑ a b National Cancer Institute (2014). «Breast Cancer Treatment». Consultado em 29 de junho de 2014
- ↑ a b International Agency for Research on Cancer (2008). «World Cancer Report» (PDF). Consultado em 26 de fevereiro de 2011
- ↑ a b World Cancer Report 2014. [S.l.]: Organização Mundial de Saúde. 2014. pp. Capítulo 1.1. ISBN 92-832-0429-8
- ↑ National Cancer Institute (2014). «Male Breast Cancer Treatment». Consultado em 29 de junho de 2014
- ↑ a b c Merck Manual (2003). «Breast Disorders: Breast Cancer». Consultado em 5 de fevereiro de 2008
- ↑ Liga Portuguesa contra o Cancro (2015). «Sinais e sintomas do cancro da mama». Consultado em 23 de agosto de 2015
- ↑ Watson, M (2008). «Assessment of suspected cancer». InnoAiT. 1 (2): 94–107. doi:10.1093/innovait/inn001
- ↑ Lacroix, M (2006). «Significance, detection and markers of disseminated breast cancer cells». Bioscientifica. Endocrine-related Cancer. 13 (4): 1033–67. PMID 17158753. doi:10.1677/ERC-06-0001
- ↑ Karakas, C (2011). «Paget's disease of the breast». Journal of carcinogenesis. 10: 31. PMC 3263015
 . PMID 22279416. doi:10.4103/1477-3163.90676
. PMID 22279416. doi:10.4103/1477-3163.90676 - ↑ Finocchi, L; Covarelli P, Rulli A, Servoli A, Noya G (2008). «Bilateral phylloid cystosarcoma of the breast: a case report and review of the literature». Chirurgia Italiana. 60: 867-872. PMID 19256279
- ↑ National Cancer Institute (2004). «Metastatic Cancer: Questions and Answers». Consultado em 6 de fevereiro de 2008
- ↑ a b American Cancer Society (2007). «Cancer Facts & Figures 2007» (PDF). Consultado em 26 de abril de 2007. Cópia arquivada (PDF) em 10 de abril de 2007
- ↑ eMedicine (2006). «Breast Cancer Evaluation». Consultado em 5 de fevereiro de 2008
- ↑ McCann, Judith A. Shilling (2008). Nursing. Ambler: Lippincott Williams & Wilkins. p. 99. ISBN 978-1-58255-668-0
- ↑ Merck Manual (2003). «Breast Disorders: Overview of Breast Disorders». Consultado em 5 de fevereiro de 2008
- ↑ a b c Hayes, James; Ricahrdson, Ann; Frampton, Chris (2013). «Population attributable risks for modifiable lifestyle factors and breast cancer in New Zealand women». IMJ. 43 (11): 1198–1204. PMID 23910051. doi:10.1111/imj.12256
- ↑ Reeder, JG; Vogel VG (2008). «Breast cancer prevention.». Cancer treatment and research. 141: 149–64. PMID 18274088. doi:10.1007/978-0-387-73161-2_10
- ↑ Collaborative Group on Hormonal Factors in Breast Cancer (2002). «Breast cancer and breastfeeding: collaborative reanalysis of individual data from 47 epidemiological studies in 30 countries, including 50302 women with breast cancer and 96973 women without the disease.». Lancet. 360 (9328): 187–95. PMID 12133652. doi:10.1016/S0140-6736(02)09454-0
- ↑ Yager, JD; Davidson NE (2006). «Estrogen carcinogenesis in breast cancer». New Engl J Med. 354(3): 270–82. PMID 16421368. doi:10.1056/NEJMra050776
- ↑ Carroll, KK (1998). «Obesity as a risk factor for certain types of cancer». Lipids. 33 (11): 1055-1059. doi:10.1007/s11745-998-0305-8
- ↑ Johnson, KC; Miller AB, Collishaw NE, Palmer JR, Hammond SK, Salmon AG, Cantor KP, Miller MD, Boyd NF, Millar J, Turcotte F (2011). «Active smoking and secondhand smoke increase breast cancer risk: the report of the Canadian Expert Panel on Tobacco Smoke and Breast Cancer Risk (2009).». Tobacco control. 20(1): e2. PMID 21148114. doi:10.1136/tc.2010.035931
- ↑ Lee, IM; Shiroma EJ, Lobelo F, Puska P, Blair SN, Katzmarzyk PT (2012). «Effect of physical inactivity on major non-communicable diseases worldwide: an analysis of burden of disease and life expectancy». The Lancet. 380 (9838): 219–29. PMC 3645500
 . PMID 22818936. doi:10.1016/S0140-6736(12)61031-9
. PMID 22818936. doi:10.1016/S0140-6736(12)61031-9 - ↑ Biswas, A; Oh PI, Faulkner GE, Bajaj RR, Silver MA, Mitchell MS, Alter DA (2015). «Sedentary Time and Its Association With Risk for Disease Incidence, Mortality, and Hospitalization in Adults: A Systematic Review and Meta-analysis». Annals of Internal Medicine. 162 (2): 123–32. PMID 25599350. doi:10.7326/M14-1651
- ↑ Blackburn, GL; Wang KA (2007). «Dietary fat reduction and breast cancer outcome: results from the Women's Intervention Nutrition Study (WINS).». The American journal of clinical nutrition. 86 (3): s878–81. PMID 18265482
- ↑ Boffetta, P; Hashibe M, La Vecchia C, Zatonski W, Rehm J (2006). «The burden of cancer attributable to alcohol drinking». International Journal of Cancer. 119(4): 884–7. PMID 16557583. doi:10.1002/ijc.21903
- ↑ Kaiser, J (2013). «Cancer. Cholesterol forges link between obesity and breast cancer.». Science. 342(6162): 1028. PMID 24288308. doi:10.1126/science.342.6162.1028
- ↑ Aceves, C; Anguiano B, Delgado G (2005). «Is iodine a gatekeeper of the integrity of the mammary gland?». Journal of Mammary Gland Biology and Neoplasia. 10(2): 189–96. PMID 16025225. doi:10.1007/s10911-005-5401-5
- ↑ Kahlenborn, C; Modugno F, Potter DM, Severs WB (2006). «Oral contraceptive use as a risk factor for premenopausal breast cancer: a meta-analysis.». Mayo Clinic proceedings. 81 (10): 1290–302. PMID 17036554. doi:10.4065/81.10.1290
- ↑ a b Casey, PM; Cerhan JR, Pruthi S (2008). «Oral contraceptive use and risk of breast cancer.». Mayo Clinic proceedings. 83 (1): 86–90. PMID 18174010. doi:10.4065/83.1.86
- ↑ Iodice, S; Barile M, Rotmensz N, Feroce I, Bonanni B, Radice P, Bernard L, Maisonneuve P, Gandini S (2010). «Oral contraceptive use and breast or ovarian cancer risk in BRCA1/2 carriers: a meta-analysis.». European journal of cancer. 46 (12): 2275–84. PMID 20537530. doi:10.1016/j.ejca.2010.04.018
- ↑ Gaffield, ME; Culwell KR, Ravi A (2009). «Oral contraceptives and family history of breast cancer.». Contraception. 80 (4): 372–80. PMID 19751860. doi:10.1016/j.contraception.2009.04.010
- ↑ Cavalieri E, Chakravarti D, Guttenplan J, Hart E, Ingle J, Jankowiak R, Muti P, Rogan E, Russo J, Santen R, Sutter T (Agosto de 2006). «Catechol estrogen quinones as initiators of breast and other human cancers: implications for biomarkers of susceptibility and cancer prevention». Biochimica et Biophysica Acta. 1766 (1): 63–78. PMID 16675129. doi:10.1016/j.bbcan.2006.03.001
- ↑ Yang, L; Jacobsen KH (2008). «A systematic review of the association between breastfeeding and breast cancer.». Journal of Women's Health. 17 (10): 1635–45. PMID 19049358. doi:10.1089/jwh.2008.0917
- ↑ Russo, J; Russo IH (1980). «Susceptibility of the mammary gland to carcinogenesis. II. Pregnancy interruption as a risk factor in tumor incidence». Am J Pathol. 100 (2): 505–506. PMC 1903536
 . PMID 6773421.
. PMID 6773421. In contrast, abortion is associated with increased risk of carcinomas of the breast. The explanation for these epidemiologic findings is not known, but the parallelism between the DMBA-induced rat mammary carcinoma model and the human situation is striking. ... Abortion would interrupt this process, leaving in the gland undifferentiated structures like those observed in the rat mammary gland, which could render the gland again susceptible to carcinogenesis.
- ↑ Beral, V; Bull D, Doll R, Peto R, Reeves G (2004). «Breast cancer and abortion: collaborative reanalysis of data from 53 epidemiological studies, including 83?000 women with breast cancer from 16 countries.». Lancet. 363 (9414): 1007–16. PMID 15051280. doi:10.1016/S0140-6736(04)15835-2
- ↑ a b American Cancer Society (2005). «Breast Cancer Facts & Figures 2005–2006» (PDF). Consultado em 26 de abril de 2007. Cópia arquivada (PDF) em 13 de junho de 2007
- ↑ Wang, XS; Armstrong ME, Cairns BJ, Key TJ, Travis RC (2011). «Shift work and chronic disease: the epidemiological evidence.». Occupational medicine (Oxford, England). 61 (2): 78–89. PMC 3045028
 . PMID 21355031. doi:10.1093/occmed/kqr001
. PMID 21355031. doi:10.1093/occmed/kqr001 - ↑ Brody, JG; Rudel RA, Michels KB, Moysich KB, Bernstein L, Attfield KR, Gray S (2007). «Environmental pollutants, diet, physical activity, body size, and breast cancer: where do we stand in research to identify opportunities for prevention?». Cancer. 109 (12 Suppl): 2627–34. PMID 17503444. doi:10.1002/cncr.22656
- ↑ Ferro, Roberto (2012). «Pesticides and Breast Cancer». Advances in Breast Cancer Research. 1 (3): 30–35. doi:10.4236/abcr.2012.13005
- ↑ Carolyn E. Eberle, Dale P. Sandler, Kyla W. Taylor, Alexandra J. White (3 de dezembro de 2019). «Hair dye and chemical straightener use and breast cancer risk in a large US population of black and white women». Int. J. Cancer. doi:10.1002/ijc.32738
- ↑ Hendrick, RE (2010). «Radiation doses and cancer risks from breast imaging studies.». Radiology. 257 (1): 246–53. PMID 20736332. doi:10.1148/radiol.10100570
- ↑ a b c Gage, M; Wattendorf D, Henry LR (2012). «Translational advances regarding hereditary breast cancer syndromes». Journal of surgical oncology. 105(5): 444–51. PMID 22441895. doi:10.1002/jso.21856
- ↑ a b Pasche, Boris (2010). Cancer Genetics (Cancer Treatment and Research). Berlim: Springer. pp. 19–20. ISBN 1-4419-6032-5
- ↑ «Predisposição hereditária ao câncer de mama e sua relação com os genes BRCA1 e BRCA2: revisão da literatura». Revista RBAC. Consultado em 21 de maio de 2021
- ↑ «Familial breast cancer: collaborative reanalysis of individual data from 52 epidemiological studies including 58,209 women with breast cancer and 101,986 women without the disease.». Lancet. 358 (9291): 1389–99. 2001. PMID 11705483. doi:10.1016/S0140-6736(01)06524-2
- ↑ Nelson, HD; Zakher B, Cantor A, Fu R, Griffin J, O'Meara ES, Buist DS, Kerlikowske K, van Ravesteyn NT, Trentham-Dietz A, Mandelblatt JS, Miglioretti DL (2012). «Risk factors for breast cancer for women aged 40 to 49 years: a systematic review and meta-analysis.». Annals of Internal Medicine. 156 (9): 635–48. PMC 3561467
 . PMID 22547473. doi:10.1059/0003-4819-156-9-201205010-00006
. PMID 22547473. doi:10.1059/0003-4819-156-9-201205010-00006 - ↑ Kouros-Mehr H, Kim JW, Bechis SK, Werb Z (abril de 2008). «GATA-3 and the regulation of the mammary luminal cell fate.». Current opinion in cell biology. 20(2): 164–70. PMC 2397451
 . PMID 18358709. doi:10.1016/j.ceb.2008.02.003
. PMID 18358709. doi:10.1016/j.ceb.2008.02.003 - ↑ Afonso, N; Bouwman D (2008). «Lobular carcinoma in situ». Eur. J. Cancer Prev. 17 (4): 312–6. PMID 18562954. doi:10.1097/CEJ.0b013e3282f75e5d
- ↑ Anothaisintawee, T; Wiratkapun C, Lerdsitthichai P, Kasamesup V, Wongwaisayawan S, Srinakarin J, Hirunpat S, Woodtichartpreecha P, Boonlikit S, Teerawattananon Y, Thakkinstian A (2013). «Risk factors of breast cancer: a systematic review and meta-analysis». Asian Pacific Journal of Public Health. 25 (5): 368–387. PMID 23709491. doi:10.1177/1010539513488795
- ↑ a b c d Ribeiro, Joana Inácio (2014). Carcinoma mamário: estado da arte (PDF). Lisboa: Faculdade de Ciências e Tecnologias da Saúde
- ↑ Adrian Lee; Carlos Arteaga (14 de dezembro de 2009). 32nd Annual CTRC-AACR San Antonio Breast Cancer Symposium (PDF). Sunday Morning Year-End Review. [S.l.: s.n.] Consultado em 6 de Fevereiro de 2016. Arquivado do original (PDF) em 13 de Agosto de 2013
- ↑ Williams C, Edvardsson K, Lewandowski SA, Stram A, Gustafsson JA. (2008). «A genome-wide study of the repressive effects of estrogen receptor beta on estrogen receptor alpha signaling in breast cancer cells.». Oncogene (27): 1019-1032
- ↑ Dias, Ana Margarida de Azevedo (2010). Inibidores da aromatase e cancro da mama: Avaliação biológica de novas moléculas esteroides. [S.l.]: Faculdade de Farmácia da Universidade do Porto
- ↑ Cunha S, Gano L, Morais GR, Thiemann T, Oliveira MC (2013). «Progesterone receptor targeting with radiolabelled steroids: an approach in predicting breast cancer response to therapy». J Steroid Biochem Mol Biol. (137): 223-41. doi:10.1016/j.jsbmb.2013.04.003
- ↑ Saudade André, Ana Raquel Tomás, Ricardo Fonseca (2005). «Carcinoma da Mama: Determinação da Amplificação do HER2 por Hibridação in situ de Fluorescência (FISH)». Acta Med Port (18): 417-422
- ↑ Haslam SZ, Woodward TL (Junho de 2003). «Host microenvironment in breast cancer development: epithelial-cell-stromal-cell interactions and steroid hormone action in normal and cancerous mammary gland.». Breast Cancer Res. 5 (4): 208–15. PMC 165024
 . PMID 12817994. doi:10.1186/bcr615
. PMID 12817994. doi:10.1186/bcr615 - ↑ Wiseman BS, Werb Z (Maio de 2002). «Stromal effects on mammary gland development and breast cancer». Science. 296 (5570): 1046–9. PMC 2788989
 . PMID 12004111. doi:10.1126/science.1067431
. PMID 12004111. doi:10.1126/science.1067431 - ↑ Jardé T, Perrier S, Vasson MP, Caldefie-Chézet F (Janeiro de 2011). «Molecular mechanisms of leptin and adiponectin in breast cancer». Eur. J. Cancer. 47 (1): 33–43. PMID 20889333. doi:10.1016/j.ejca.2010.09.005
- ↑ Dunning AM, Healey CS, Pharoah PD, Teare MD, Ponder BA, Easton DF (outubro de 1999). «A systematic review of genetic polymorphisms and breast cancer risk». Cancer Epidemiology, Biomarkers & Prevention. 8 (10): 843–54. PMID 10548311
- ↑ Begg CB, Haile RW, Borg A, Malone KE, Concannon P, Thomas DC, Langholz B, Bernstein L, Olsen JH, Lynch CF, Anton-Culver H, Capanu M, Liang X, Hummer AJ, Sima C, Bernstein JL (janeiro de 2008). «Variation of breast cancer risk among BRCA1/2 carriers». JAMA. 299 (2): 194–201. PMC 2714486
 . PMID 18182601. doi:10.1001/jama.2007.55-a
. PMID 18182601. doi:10.1001/jama.2007.55-a - ↑ Patel KJ, Yu VP, Lee H, Corcoran A, Thistlethwaite FC, Evans MJ, Colledge WH, Friedman LS, Ponder BA, Venkitaraman AR (Fevereiro de 1998). «Involvement of Brca2 in DNA repair». Mol. Cell. 1 (3): 347–57. PMID 9660919. doi:10.1016/S1097-2765(00)80035-0
- ↑ Marietta C, Thompson LH, Lamerdin JE, Brooks PJ (Maio de 2009). «Acetaldehyde stimulates FANCD2 monoubiquitination, H2AX phosphorylation, and BRCA1 phosphorylation in human cells in vitro: implications for alcohol-related carcinogenesis». Mutat. Res. 664 (1–2): 77–83. PMC 2807731
 . PMID 19428384. doi:10.1016/j.mrfmmm.2009.03.011
. PMID 19428384. doi:10.1016/j.mrfmmm.2009.03.011 - ↑ Theruvathu JA, Jaruga P, Nath RG, Dizdaroglu M, Brooks PJ (2005). «Polyamines stimulate the formation of mutagenic 1,N2-propanodeoxyguanosine adducts from acetaldehyde». Nucleic Acids Res. 33 (11): 3513–20. PMC 1156964
 . PMID 15972793. doi:10.1093/nar/gki661
. PMID 15972793. doi:10.1093/nar/gki661 - ↑ Wooster R, Weber BL (junho de 2003). «Breast and ovarian cancer». N. Engl. J. Med. 348 (23): 2339–47. PMID 12788999. doi:10.1056/NEJMra012284
- ↑ a b c d e f g h i «Diagnosis». American Society of Clinical Oncology. Fevereiro de 2016. Consultado em 29 de maio de 2016
- ↑ Saslow, D; Hannan J, Osuch J, Alciati MH, Baines C, Barton M, Bobo JK, Coleman C, Dolan M, Gaumer G, Kopans D, Kutner S, Lane DS, Lawson H, Meissner H, Moorman C, Pennypacker H, Pierce P, Sciandra E, Smith R, Coates R (2004). «Clinical breast examination: practical recommendations for optimizing performance and reporting». CA: a cancer journal for clinicians. 54 (6): 327–344. PMID 15537576. doi:10.3322/canjclin.54.6.327
- ↑ a b c Yu, YH; Liang C, Yuan XZ (2010). «Diagnostic value of vacuum-assisted breast biopsy for breast carcinoma: a meta-analysis and systematic review.». Breast cancer research and treatment. 120 (2): 469–79. PMID 20130983. doi:10.1007/s10549-010-0750-1
- ↑ Carlson, RW; Allred DC, Anderson BO, Burstein HJ, Carter WB, Edge SB, Erban JK, Farrar WB, Goldstein LJ, Gradishar WJ, Hayes DF, Hudis CA, Jahanzeb M, Kiel K, Ljung BM, Marcom PK, Mayer IA, McCormick B, Nabell LM, Pierce LJ, Reed EC, Smith ML, Somlo G, Theriault RL, Topham NS, Ward JH, Winer EP, Wolff AC (2009). «Breast cancer. Clinical practice guidelines in oncology». Journal of the National Comprehensive Cancer Network : JNCCN. 7 (2): 122–192. PMID 19200416
- ↑ a b c d «How is breast cancer classified?». American Cancer Society. 4 de maio de 2016. Consultado em 21 de junho de 2016
- ↑ a b c Li CI; Uribe DJ; Daling JR (2005). «Clinical characteristics of different histologic types of breast cancer.». Br J Cancer. 93 (9): 1046. doi:10.1038/sj.bjc.6602787
- ↑ Merck Manual (2015). «Breast Cancer». Consultado em 26 de agosto de 2015
- ↑ a b «Overview». American Society of Clinical Oncology. Fevereiro de 2016. Consultado em 30 de maio de 2016
- ↑ Elston, CW; Ellis IO (1991). «Pathological prognostic factors in breast cancer. I. The value of histological grade in breast cancer: experience from a large study with long-term follow-up». Histopathology. 19 (5): 403–10. PMID 1757079. doi:10.1111/j.1365-2559.1991.tb00229.x
- ↑ Bouche, Gauthier; Piccart, Martine; Pestalozzi, Bernhard; Catane, Raphael (2013). Cancro da Mama: Um Guia Para o Doente (PDF) 3ª ed. [S.l.]: Anticancer Fund. p. 12
- ↑ Magno Belém Cirqueira, Marise Amaral Rebouças Moreira, Leonardo Ribeiro Soares, Ruffo Freitas-Júnior (2011). «Subtipos moleculares do câncer de mama»(PDF). FEMINA (revisão). 39 (10): 499-503
- ↑ a b c d «Breast Cancer: Stages». American Society of Clinical Oncology. Fevereiro de 2016. Consultado em 19 de maio de 2016
- ↑ a b «Breast Cancer: Stages». American Society of Clinical Oncology. Fevereiro de 2016. Consultado em 9 de maio de 2016
- ↑ a b «Breast Cancer Staging». Cancer Research UK. Consultado em 19 de maio de 2016
- ↑ a b Marmot, M; Atinmo, T; Byers, T; Chen, J; Hirohata, T; Jackson, A; James, W; Kolonel, L; Kumanyika, S; Leitzmann, C; Mann, J; Powers, H; Reddy, K; Riboli, E; Rivera, JA; Schatzkin, A; Seidell, J; Shuker, D; Uauy, R; Willett, W; Zeisel, S (2007). Food, Nutrition, Physical Activity, and the Prevention of Cancer: A Global Perspective (PDF). Col: World Cancer Research Fund / American Institute for Cancer Research (AICR) Expert Reports. 2. Washington, DC: AICR. ISBN 9780972252225
- ↑ Eliassen, AH; Hankinson SE, Rosner B, Holmes MD, Willett WC (2010). «Physical activity and risk of breast cancer among postmenopausal women». Arch. Intern. Med. 170 (19): 1758–64. PMC 3142573
 . PMID 20975025. doi:10.1001/archinternmed.2010.363
. PMID 20975025. doi:10.1001/archinternmed.2010.363 - ↑ Zheng, JS; Hu XJ, Zhao YM, Yang J, Li D (2013). «Intake of fish and marine n-3 polyunsaturated fatty acids and risk of breast cancer: meta-analysis of data from 21 independent prospective cohort studies». BMJ. 346: f3706. PMID 23814120. doi:10.1136/bmj.f3706
- ↑ Wu, AH; Yu, MC; Tseng, CC; Pike, MC (2008). «Epidemiology of soy exposures and breast cancer risk.». British journal of cancer. 98 (1): 9–14. PMID 18182974. doi:10.1038/sj.bjc.6604145
- ↑ Hartmann, LC; Schaid DJ, Woods JE, Crotty TP, Myers JL, Arnold PG, Petty PM, Sellers TA, Johnson JL, McDonnell SK, Frost MH, Jenkins RB (1999). «Efficacy of bilateral prophylactic mastectomy in women with a family history of breast cancer». N Engl J Med. 340 (2): 77–84. PMID 9887158. doi:10.1056/NEJM199901143400201
- ↑ Meijers-Heijboer, H; van Geel B, van Putten WL, Henzen-Logmans SC, Seynaeve C, Menke-Pluymers MB, Bartels CC, Verhoog LC, van den Ouweland AM, Niermeijer MF, Brekelmans CT, Klijn JG (2001). «Breast cancer after prophylactic bilateral mastectomy in women with BRCA1 and BRCA2 mutations». N Engl J Med. 345(3): 159–164. PMID 11463009. doi:10.1056/NEJM200107193450301
- ↑ Lostumbo, L; Carbine, NE; Wallace, J (2010). «Prophylactic mastectomy for the prevention of breast cancer.». The Cochrane database of systematic reviews(11): CD002748. PMID 21069671. doi:10.1002/14651858.CD002748.pub3
- ↑ Moyer, VA; U.S. Preventive Services Task Force (2013). «Risk Assessment, Genetic Counseling, and Genetic Testing for BRCA-Related Cancer in Women: U.S. Preventive Services Task Force Recommendation Statement». Annals of Internal Medicine. 160: 271–281. doi:10.7326/M13-2747
- ↑ Nelson, HD; Smith ME, Griffin JC, Fu R (2013). «Use of medications to reduce risk for primary breast cancer: a systematic review for the U.S. Preventive Services Task Force.». Annals of Internal Medicine. 158 (8): 604–14. PMID 23588749. doi:10.7326/0003-4819-158-8-201304160-00005
- ↑ a b Cuzick, J; Sestak I, Bonanni B, Costantino JP, Cummings S, DeCensi A, Dowsett M, Forbes JF, Ford L, LaCroix AZ, Mershon J, Mitlak BH, Powles T, Veronesi U, Vogel V, Wickerham DL (2013). «Selective oestrogen receptor modulators in prevention of breast cancer: an updated meta-analysis of individual participant data». The Lancet. 381 (9880): 1827–34. PMID 23639488. doi:10.1016/S0140-6736(13)60140-3
- ↑ Moyer, VA (2013). «Medications for Risk Reduction of Primary Breast Cancer in Women: U.S. Preventive Services Task Force Recommendation Statement.». Annals of Internal Medicine. PMID 24061472. doi:10.7326/0003-4819-159-10-201311190-00718
- ↑ a b «Screening». Centers for Disease Control and Prevention. 14 de setembro de 2020. Consultado em 21 de dezembro de 2020
- ↑ «Can breast cancer be found early?». American Cancer Society. 4 de maio de 2016. Consultado em 23 de junho de 2016
- ↑ Biesheuvel, C; Weigel S, Heindel W (2011). «Mammography Screening: Evidence, History and Current Practice in Germany and Other European Countries.». Breast care (Basel, Switzerland). 6 (2): 104–109. PMID 21673820. doi:10.1159/000327493
- ↑ United States Preventive Services Task Force. «Breast Cancer: Screening». Consultado em 28 de agosto de 2015
- ↑ WebMD. «Breast Cancer and Mammograms». Consultado em 24 de dezembro de 2012
- ↑ Croswell JM, Kramer BS, Kreimer AR (2009). «Cumulative incidence of false-positive results in repeated, multimodal cancer screening». Annals of Family Medicine. 7 (3): 212–22. PMC 2682972
 . PMID 19433838. doi:10.1370/afm.942
. PMID 19433838. doi:10.1370/afm.942 - ↑ Smith-Bindman R, Ballard-Barbash R, Miglioretti DL, Patnick J, Kerlikowske K (2005). «Comparing the performance of mammography screening in the USA and the UK». Journal of Medical Screening. 12 (1): 50–4. PMID 15814020. doi:10.1258/0969141053279130
- ↑ Welch, H Gilbert (2006). «Ramifications of screening for breast cancer». British Medical Journal. 332(7543). PMC 1410868
 . doi:10.1136/bmj.332.7543.727
. doi:10.1136/bmj.332.7543.727 - ↑ Aschwanden, Christie (2007). «The trouble with mammograms». Los Angeles Times. Consultado em 3 de setembro de 2015
- ↑ «Screening for breast cancer: U.S. Preventive Services Task Force recommendation statement.». Annals of internal medicine. 151 (10): 716–26, W–236. 2009. PMID 19920272. doi:10.1059/0003-4819-151-10-200911170-00008
- ↑ Kösters, JP; Gøtzsche PC (2003). «Regular self-examination or clinical examination for early detection of breast cancer.». Cochrane Database Syst Rev (2): CD003373. PMID 12804462. doi:10.1002/14651858.CD003373
- ↑ Nelson HD, Tyne K, Naik A; et al. (2009). Screening for Breast Cancer: Systematic Evidence Review Update for the US Preventive Services Task Force. Col: Evidence Syntheses, 74. Rockville: Agency for Healthcare Research and Quality (US)
- ↑ Kösters JP, Gøtzsche PC (2003). «Regular self-examination or clinical examination for early detection of breast cancer». Cochrane Database Syst Rev (2): CD003373. PMID 12804462. doi:10.1002/14651858.CD003373
- ↑ José Agostinho Santos (2013). «Auto-exame da mama no rastreio do cancro mamário: soma-se a evidência, apaga-se a incerteza» (PDF). Acta Obstet Ginecol Port. 7 (2): 113-117
- ↑ Saslow D, Hannan J, Osuch J; et al. (2004). «Clinical breast examination: practical recommendations for optimizing performance and reporting». CA Cancer J Clin. 54 (6): 327–44. PMID 15537576. doi:10.3322/canjclin.54.6.327
- ↑ Nelson HD, Tyne K, Naik A; et al. (2009). «Screening for Breast Cancer: Systematic Evidence Review Update for the US Preventive Services Task Force». Agency for Healthcare Research and Quality. Evidence Syntheses (74).
- ↑ João Moura Pereira (ed.). Cancro da Mama: Protocolo de diagnóstico, terapêutica e seguimento (PDF). [S.l.]: IPO Coimbra. p. 50
- ↑ Welch, HG, Passow HJ (2013). «Quantifying the Benefits and Harms of Screening Mammography.». JAMA internal medicine. 174 (3): 448–54. PMID 24380095. doi:10.1001/jamainternmed.2013.13635
- ↑ a b Gøtzsche, PC; Nielsen M (2011). «Screening for breast cancer with mammography». Cochrane Database Syst Rev (1): CD001877. PMID 21249649. doi:10.1002/14651858.CD001877.pub4
- ↑ a b c d «Breast Cancer - Treatment Options». American Society of Clinical Oncology. Fevereiro de 2016. Consultado em 9 de maio de 2016
- ↑ Saini, KS; Taylor C, Ramirez AJ, Palmieri C, Gunnarsson U, Schmoll HJ, Dolci SM, Ghenne C, Metzger-Filho O, Skrzypski M, Paesmans M, Ameye L, Piccart-Gebhart MJ, de Azambuja E (2011). «Role of the multidisciplinary team in breast cancer management: results from a large international survey involving 39 countries». Annals of Oncology. 23 (4): 853–9. PMID 21821551. doi:10.1093/annonc/mdr352
- ↑ «Breast Cancer Treatment». American Society of Clinical Oncology. Consultado em 27 de junho de 2016
- ↑ Massarut, S; Baldassare G, Belleti B, Reccanello S, D'Andrea S, Ezio C, Perin T, Roncadin M, Vaidya JS (2006). «Intraoperative radiotherapy impairs breast cancer cell motility induced by surgical wound fluid». J Clin Oncol. 24 (18S): 10611
- ↑ Belletti, B; Vaidya JS, D'Andrea S, Entschladen F, Roncadin M, Lovat F, Berton S, Perin T, Candiani E, Reccanello S, Veronesi A, Canzonieri V, Trovò MG, Zaenker KS, Colombatti A, Baldassarre G, Massarut S (2008). «Targeted intraoperative radiotherapy impairs the stimulation of breast cancer cell proliferation and invasion caused by surgical wounding». Clin. Cancer Res. 14 (5): 1325–32. PMID 18316551. doi:10.1158/1078-0432.CCR-07-4453
- ↑ Vaidya, JS; Joseph DJ, Tobias JS, Bulsara M, Wenz F, Saunders C, Alvarado M, Flyger HL, Massarut S, Eiermann W, Keshtgar M, Dewar J, Kraus-Tiefenbacher U, Sütterlin M, Esserman L, Holtveg HM, Roncadin M, Pigorsch S, Metaxas M, Falzon M, Matthews A, Corica T, Williams NR, Baum M (2010). «Targeted intraoperative radiotherapy versus whole breast radiotherapy for breast cancer (TARGIT-A trial): an international, prospective, randomised, non-inferiority phase 3 trial». Lancet. 376(9735): 91–102. PMID 20570343. doi:10.1016/S0140-6736(10)60837-9
- ↑ Burstein, HJ; Temin, S; Anderson, H; Buchholz, TA; Davidson, NE; Gelmon, KE; Giordano, SH; Hudis, CA; Rowden, D; Solky, AJ; Stearns, V; Winer, EP; Griggs, JJ (2014). «Adjuvant Endocrine Therapy for Women With Hormone Receptor-Positive Breast Cancer: American Society of Clinical Oncology Clinical Practice Guideline Focused Update.». Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 32(21): 2255–69. PMID 24868023. doi:10.1200/JCO.2013.54.2258
- ↑ Bao, Ting; Rudek, Michelle A (2011). «The Clinical Pharmacology of Anastrozole». European Oncology & Haematology. 7 (2): 106–8. doi:10.17925/EOH.2011.07.02.106
- ↑ EBCTCG, Early Breast Cancer Trialists' Collaborative Group (2015). «Aromatase inhibitors versus tamoxifen in early breast cancer: patient-level meta-analysis of the randomised trials». The Lancet. doi:10.1016/S0140-6736(15)61074-1
- ↑ Petit, T; Dufour P, Tannock I (2011). «A critical evaluation of the role of aromatase inhibitors as adjuvant therapy for postmenopausal women with breast cancer». Endocr. Relat. Cancer. 18 (3): R79–89. PMID 21502311. doi:10.1530/ERC-10-0162
- ↑ Pereira, João Moura; et al. (2012). Cancro da Mama: Protocolo de diagnóstico, terapêutica e seguimento(PDF). [S.l.]: Instituto Português de Oncologia de Coimbra
- ↑ Jahanzeb, M (2008). «Adjuvant trastuzumab therapy for HER2-positive breast cancer». Clin. Breast Cancer. 8(4): 324–33. PMID 18757259. doi:10.3816/CBC.2008.n.037
- ↑ NCBI, National Center for Biotechnology Information (2015). «ERBB2 erb-b2 receptor tyrosine kinase 2 Homo sapiens (human)». Consultado em 28 de agosto de 2015
- ↑ «Herceptin (trastuzumab) Adjuvant HER2+ Breast Cancer Therapy Pivotal Studies and Efficacy Data». Herceptin.com. Consultado em 8 de maio de 2010
- ↑ «Prognosis». Breast Cancer Care UK. Consultado em 27 de junho de 2016
- ↑ a b c Kosir, Mary Ann (2013). «Breast Cancer: Breast Disorders: Merck Manual Professional». Manual Merck. Consultado em 30 de agosto de 2015
- ↑ NCI, National Cancer Institute and the National Research Center for Women & Families (2004). «Surgery Choices for Women with Early Stage Breast Cancer» (PDF). Consultado em 30 de agosto de 2015. Arquivado do original (PDF) em 13 de Agosto de 2013
- ↑ Gonzalez-Angulo, AM; Litton JK, Broglio KR, Meric-Bernstam F, Rakkhit R, Cardoso F, Peintinger F, Hanrahan EO, Sahin A, Guray M, Larsimont D, Feoli F, Stranzl H, Buchholz TA, Valero V, Theriault R, Piccart-Gebhart M, Ravdin PM, Berry DA, Hortobagyi GN (2009). «High risk of recurrence for patients with breast cancer who have human epidermal growth factor receptor 2-positive, node-negative tumors 1 cm or smaller». J. Clin. Oncol. 27 (34): 5700–6. PMC 2792998
 . PMID 19884543. doi:10.1200/JCO.2009.23.2025
. PMID 19884543. doi:10.1200/JCO.2009.23.2025 - ↑ Peppercorn, J (2009). «Breast Cancer in Women Under 40». Oncology. 23 (6): 465-474
- ↑ Gierach, GL; Ichikawa L, Kerlikowske K, Brinton LA, Farhat GN, Vacek PM, Weaver DL, Schairer C, Taplin SH, Sherman ME (2012). «Relationship between mammographic density and breast cancer death in the Breast Cancer Surveillance Consortium». Journal of National Cancer Institute. 104 (16): 1218–27. PMID 22911616. doi:10.1093/jnci/djs327
- ↑ Klein, Judith; Ji M, Rea NK, Stoodt G (2011). «Differences in male breast cancer stage, tumor size at diagnosis, and survival rate between metropolitan and nonmetropolitan regions». Am J Mens Health. 5 (5): 430-7. doi:10.1177/1557988311400403
- ↑ McNaught J, Reid RL, Provencher DM (julho de 2006). «Progesterone-only and non-hormonal contraception in the breast cancer survivor: Joint Review and Committee Opinion of the Society of Obstetricians and Gynaecologists of Canada and the Society of Gynecologic Oncologists of Canada». J Obstet Gynaecol Can. 28 (7): 616–39. PMID 16924781
- ↑ The Royal Australian and New Zealand College of Obstetricians and Gynaecologists (Novembro de 2014). «Management of the menopause after breast cancer». C-Gyn. 15. Consultado em 7 de Abril de 2016. Arquivado do original em 7 de Abril de 2016
- ↑ «Self Image and Cancer». American Society of Clinical Oncology. Consultado em 21 de maio de 2016
- ↑ Pritchard, KI (2009). «Ovarian Suppression/Ablation in Premenopausal ER-Positive Breast Cancer Patients». Oncology. 23 (1)
- ↑ «Anxiety». American Society of Clinical Oncology. Consultado em 21 de maio de 2016
- ↑ OMS, Organização Mundial de Saúde (201). «WHO Disease and injury country estimates». Consultado em 30 de agosto de 2015
- ↑ a b «Breast cancer burden». Organização Mundial de Saúde. Consultado em 18 de maio de 2016. Arquivado do original em 6 de Setembro de 2015
- ↑ OMS, Organização Mundial de Saúde (2012). «Breast Cancer: Estimated Incidence, Mortality and Prevalence Worldwide in 2012». Who.int. Consultado em 30 de agosto de 2015
- ↑ Guerra, Maximiliano Ribeiro Guerra; de Moura Gallo, Cláudia Vitória; Azevedo e Silva Mendonça, Gulnar (2005). «Risco de câncer no Brasil: tendências e estudos epidemiológicos mais recentes» (PDF). Revista Brasileira de Cancerologia. 51 (3): 227-234
- ↑ Instituto Nacional de Câncer; Ministério da Saúde (2003). Câncer no Brasil: dados dos registros de base populacional, vol 3. Rio de Janeiro: INCA
- ↑ Koifman, S; Koifman RJ, Meyer A. (2002). «Human reproductive system disturbances and pesticide exposure in Brazil». Cad Saúde Pública. 18 (2): 435-45
- ↑ a b Nuno Miranda, Cristina Portugal (2014). Portugal - Doenças Oncológicas em Números. Lisboa: Direção Geral da Saúde. pp. 11–13
- ↑ a b Aronowitz, Robert A. (2007). Unnatural history: breast cancer and American society. Cambridge: Cambridge University Press. pp. 22–24. ISBN 0-521-82249-1
- ↑ a b Olson, James Stuart (2002). Bathsheba's breast: women, cancer & history. Baltimore: The Johns Hopkins University Press. pp. 9–13. ISBN 0-8018-6936-6
- ↑ Reuters (2015). «Oldest evidence of breast cancer found in Egyptian skeleton». Consultado em 25 de março de 2015
- ↑ a b Olson 2002, pp. 32–33
- ↑ Yalom, Marilyn (1997). A history of the breast. Nova Iorque: Alfred A. Knopf. p. 234. ISBN 0-679-43459-3
- ↑ a b c d e Olson 2002, pp. 102–6
- ↑ Olson 2002, p. 1
- ↑ Lacroix, Marc (2011). A Concise History of Breast Cancer. Estados Unidos: Nova Science Publishers. pp. 59–68. ISBN 978-1-61122-305-7
- ↑ Sulik, Gayle A. (2010). Pink Ribbon Blues: How Breast Cancer Culture Undermines Women's Health. [S.l.]: Oxford University Press. pp. 200–3. ISBN 0-19-974045-3. OCLC 535493589
- ↑ Rettig, Richard A.; Peter D. Jacobson, Cynthia M. Farquhar, Wade M. Aubry (2007). False Hope: Bone Marrow Transplantation for Breast Cancer. Nova Iorque: Oxford University Press. ISBN 978-0-19-518776-2
- ↑ Sulik 2010, pp. 37–38
- ↑ Sulik 2010, p. 4
- ↑ Riter, Bob (2010). «History of Breast Cancer Advocacy». Cancer Resource Center of the Finger Lakes. Consultado em 29 de junho de 2013. Arquivado do original em 23 de Junho de 2013
- ↑ Sulik 2010, pp. 27–72.
- ↑ Sulik 2010, pp. 359–361
- ↑ Sulik 2010, pp. 366–8
- ↑ Landeman, Anne (2001). «Pinkwashing: Can Shopping Cure Breast Cancer?». Center for Media and Democracy
- ↑ Sulik 2010, pp. 365–6
- ↑ Sulik 2010, pp. 372–4
- ↑ Browne, Anthony (2001). «Cancer bias puts breasts first». Londres: The Guardian
- ↑ Arnst, Catherine (2007). «A Gender Gap in Cancer». Bloomberg Businessweek. ISSN 0007-7135
- ↑ Olson 2002, pp. 199–200
- ↑ Ramon Luengo-Fernandez, Jose Leal, Alastair Gray, Richard Sullivan (2013). «Economic burden of cancer across the European Union: a population-based cost analysis». The Lancet Oncology. 14 (12): 1165–1174. doi:10.1016/S1470-2045(13)70442-X
- ↑ a b Araújo, Andreia Monteiro; Centeno, Mónica (2010). «Cancro da mama associado à gravidez» (PDF). Acta Obstet Ginecol Port. 4 (1): 44-52
- ↑ Azim, HA; Santoro, L; Russell-Edu, W; Pentheroudakis, G; Pavlidis, N; Peccatori, FA (2012). «Prognosis of pregnancy-associated breast cancer: a meta-analysis of 30 studies.». Cancer treatment reviews. 38 (7): 834–42. PMID 22785217
- ↑ a b Yarbro, Connie Henke; Wujcik, Debra; Gobel, Barbara Holmes (2011). Cancer nursing: principles and practice 7ª ed. [S.l.]: Jones & Bartlett Publishers. pp. 901–905. ISBN 978-1-4496-1829-2
- ↑ a b c d e f g h i j k l m n o p q r s t «Advances in Breast Cancer Research». National Cancer Institute. 18 de junho de 2020. Consultado em 21 de dezembro de 2020
- ↑ Lu J (Agosto de 2015). «Palbociclib: a first-in-class CDK4/CDK6 inhibitor for the treatment of hormone-receptor positive advanced breast cancer». Journal of Hematology & Oncology. 8 (1). 98 páginas. PMC 4534142
 . PMID 26264704. doi:10.1186/s13045-015-0194-5
. PMID 26264704. doi:10.1186/s13045-015-0194-5 - ↑ «FDA approves first PI3K inhibitor for breast cancer». Food and Drug Administration (FDA). 24 de maio de 2019. Consultado em 21 de dezembro de 2020
- ↑ André F, Ciruelos E, Rubovszky G, Campone M, Loibl S, Rugo HS, et al. (maio de 2019). «PIK3CA-Mutated, Hormone Receptor-Positive Advanced Breast Cancer». The New England Journal of Medicine. 380 (20): 1929–1940. PMID 31091374. doi:10.1056/NEJMoa1813904
- ↑ «FDA approves combination of pertuzumab, trastuzumab, and hyaluronidase-zzxf for HER2-positive breast cancer». Food and Drug Administration. 29 de junho de 2020. Consultado em 21 de dezembro de 2020
- ↑ Teicher BA, Doroshow JH (novembro de 2012). «The promise of antibody-drug conjugates». N. Engl. J. Med. 367 (19): 1847–8. PMID 23134386. doi:10.1056/NEJMe1211736
- ↑ Pazdur, Richard (14 de janeiro de 2011). «FDA Approval for Lapatinib Ditosylate». Cancer.gov. Womens Health (Lond Engl). 6 (2). 173 páginas. PMID 20187722. doi:10.2217/whe.10.11
- ↑ «Neratinib Maleate». National Cancer Institute. 2 de novembro de 2020. Consultado em 21 de dezembro de 2020
- ↑ Rashmi K. Murthy, Sherene Loi, Alicia Okines, Elisavet Paplomata, Erika Hamilton, Sara A. Hurvitz, Nancy U. Lin, Virginia Borges, Vandana Abramson, Carey Anders, Philippe L. Bedard, Mafalda Oliveira; et al. (13 de fevereiro de 2020). «Tucatinib, Trastuzumab, and Capecitabine for HER2-Positive Metastatic Breast Cancer». N Engl J Med (382): 597-609. doi:10.1056/NEJMoa1914609
- ↑ John M. Seligson, Alexandra M. Patron, Michael J. Berger (17 de outubro de 2020). «Sacituzumab Govitecan-hziy: An Antibody-Drug Conjugate for the Treatment of Refractory, Metastatic, Triple-Negative Breast Cancer». Annals of Pharmacotherapy(Revisão). doi:10.1177/1060028020966548
- ↑ «Olaparib». National Cancer Institute. 6 de agosto de 2020. Consultado em 21 de dezembro de 2020
- ↑ «Talazoparib Tosylate». National Cancer Institute. 15 de julho de 2020. Consultado em 21 de dezembro de 2020
- ↑ Peter Schmid, Sylvia Adams, Hope S. Rugo, Andreas Schneeweiss, Carlos H. Barrios, Hiroji Iwata, Véronique Diéras, Roberto Hegg, Seock-Ah Im, Gail Shaw Wright, Volkmar Henschel, Luciana Molinero; et al. (29 de novembro de 2018). «Atezolizumab and Nab-Paclitaxel in Advanced Triple-Negative Breast Cancer». N Engl J Med (379): 2108-2121. doi:10.1056/NEJMoa1809615
- ↑ «SmartBra to detect cancer at the earliest stages»(em inglês). 3 de abril de 2020
- ↑ Ueberschlag, Leila (4 de março de 2020). «A smart bra for detecting early-stage breast cancer» (em inglês)
Ligações externas
- «INCA - Ações e Programas no Brasil - Programa Nacional de Controle do Câncer de Mama»
- «Guia de Apoio à Mulher com Cancro de Mama - portaldasaude.pt»
- «rastreio do Cancro da Mama, em metis - Educação para a saúde»
- «Site Português sobre o Cancro da Mama»
- «Centro de Apoio a Doentes com Cancro de Mama»
- «Portal de Oncologia Português»
- «Portal do Instituto Oncoguia»
- «Listagem dos vários tratamentos disponíveis conta o Cancro da Mama»