Tabela periódica
A tabela periódica é uma disposição sistemática dos elementos químicos ordenados por seus números atômicos, configuração eletrônica, e recorrência das propriedades periódicas. Este ordenamento mostra tendências periódicas, tais como elementos com comportamentos similares na mesma coluna. Também mostra quatro blocos retangulares com propriedades químicas similares. Em geral, dentro de uma linha (período) os elementos são metálicos na esquerda e não metálicos na direita.
As linhas da tabela são denominadas períodos; as colunas são denominadas grupos. Seis grupos têm nomes específicos além de uma numeração: por exemplo o grupo 17 são os halogênios; e o grupo 18 são os gases nobres. A tabela periódica pode ser usada para deduzir as relações entre as propriedades dos elementos, e predizer as propriedades dos novos elementos ainda não descobertos ou sintetizados. A tabela fornece uma estrutura útil para analisar o comportamento químico, e é amplamente utilizada na química e em outras ciências.
O químico Dmitri Mendeleev publicou em 1869 a primeira versão amplamente reconhecida da tabela. Seu trabalho no desenvolvimento da tabela demonstra as tendências periódicas dos elementos até então conhecidos e também prediz algumas propriedades dos elementos ainda não descobertos que iriam preencher espaços vazios em sua tabela. A maioria de suas previsões se mostrou correta quando os elementos em questão foram descobertos posteriormente. Desde então a tabela de Mendeleev tem sido expandida e refinada com a descoberta ou sínteses de novos elementos e o desenvolvimento de modelos teóricos para explicar o comportamento químico.
Todos os elementos do número atômico 1 (hidrogênio) ao 118 (Oganessônio) foram descobertos ou sintetizados, sendo as adições mais recentes (elementos 113, 115, 117 e 118) confirmadas pela IUPAC em dezembro de 2015.[1] Os primeiros 94 elementos existem naturalmente, embora alguns sejam encontrados somente em quantidades de trações e foram sintetizados em laboratório antes de serem encontrados na natureza.[notas 1] Elementos com o número atômico de 95 ao 118 foram somente sintetizados em laboratório ou reatores nucleares.[2] Têm sido buscada a síntese de elementos com números atômicos maiores. Vários elementos radionuclídeos sintéticos ou que ocorrem naturalmente também têm sido produzidos em laboratórios.
Em dezembro de 2017, a Organização das Nações Unidas declarou o ano de 2019 como o Ano Internacional da Tabela Periódica, em reconhecimento da importância da crescente constatação global de como a química promove o desenvolvimento sustentável, e fornece soluções para os desafios globais nos campos da energia, educação, agricultura e saúde.[3]
Visão geral
Cada elemento químico tem um número atômico único (Z) representando o número de prótons em seu núcleo atômico[notas 2] A maioria dos elementos tem um número diferente de nêutrons entre átomos diferentes, com estas variações sendo referidas como isótopos. Por exemplo, o carbono tem três isótopos naturais: todos têm seis prótons e a maior parte dos átomos existentes do elemento têm seis nêutrons, mas aproximadamente um porcento tem sete nêutrons e uma pequena fração tem oito nêutrons. Os isótopos não são separados na tabela periódica; eles são agrupados sob um único elemento. Elementos sem isótopos estáveis têm a massa atômica de seus isótopos mais estáveis, onde tais massas são mostradas entre parênteses.[4]
Na tabela periódica padrão, os elementos estão listados em ordem crescente do número atômico (o número de prótons no núcleo atômico). Uma nova linha (período) é iniciada quando uma nova camada eletrônica tem o seu primeiro elétron. Colunas (grupo) são determinadas pela configuração eletrônica do átomo; elementos com o mesmo número de elétrons em um subcamada estão na mesma coluna (e.g. oxigênio e selênio são da mesma coluna porque ambos têm quatro elétrons na camada p mais externa). Elementos com propriedades químicas semelhantes normalmente caem no mesmo grupo da tabela periódica, embora no bloco f, e para alguns do bloco d, os elementos no mesmo período também tendem a ter propriedades similares. Assim, é relativamente fácil predizer as propriedades químicas de um elementos se são conhecidas as propriedades dos elementos à sua volta.[5]
Até 2016, a tabela periódica contém 118 elementos confirmados, do elemento 1 (hidrogênio) até o 118 (oganesson). Os elementos 113, 115, 117 e 118 foram confirmados oficialmente pela União Internacional de Química Pura e Aplicada (IUPAC) em dezembro de 2015. Os nomes propostos, nihonium (Nh), moscóvio (Mc), tennessine (Ts) e oganesson (Og) respectivamente, foram anunciados pela IUPAC em junho de 2016.[6][7][8] Estes nomes não serão aprovados formalmente até o final da consulta pública de cinco meses que termina em novembro de 2016.[9]
Os primeiros 94 elementos ocorrem naturalmente; os 24 remanescentes, do Amerício ao Ununóctio (95-118) ocorrem apenas quando sintetizados em laboratórios. Dos 94 elementos que ocorrem naturalmente, 84 são elementos primordiais e 10 ocorrem somente a partir do decaimento radioativo dos elementos primordiais.[2] Nenhum elemento mais pesado que o Einstênio (elemento 99) foi observado em quantidades macroscópicas na forma pura, e nem o Astatino (elemento 85); o Frâncio (elemento 87) foi somente fotografado na forma de luz emitida em quantidades microscópicas (300 000 átomos).[10]
História
Em 1789, Antoine Lavoisier publicou uma lista de 33 elementos químicos. Embora Lavoisier tenha agrupado os elementos em substâncias simples, metálicas, não metálicas e salificáveis ou terrosas,[11][12] químicos passaram o século seguinte à procura de um esquema de construção mais precisa. Em 1829, Johann Wolfgang Döbereiner observou que muitos dos elementos poderiam ser agrupados em tríades (grupos de três) com base em suas propriedades químicas. Lítio, sódio e potássio, por exemplo, foram agrupados como sendo metais reativos frágeis. Döbereiner observou também que, quando organizados por peso atômico, o segundo membro de cada tríade tinha aproximadamente a média do primeiro e do terceiro.[13] Isso ficou conhecido como a lei das tríades.[14] O químico alemão Leopold Gmelin trabalhou com esse sistema e por volta de 1843 ele tinha identificado dez tríades, três grupos de quatro, e um grupo de cinco. Jean Baptiste Dumas publicou um trabalho em 1857 descrevendo as relações entre os diversos grupos de metais. Embora houvesse diversos químicos capazes de identificar relações entre pequenos grupos de elementos, não havia ainda um esquema capaz de abranger todos eles.[11][13]
Em 1869, o também químico alemão Julius Lothar Meyer publicou uma tabela com os 49 elementos conhecidos organizados pela valência, conceito desenvolvido por August Kekulé seis anos antes. A tabela revelava que os elementos com propriedades semelhantes frequentemente partilhavam a mesma valência.[15] O químico inglês John Newlands publicou uma série de trabalhos em 1863 e 1866 que descreviam sua tentativa de classificar os elementos: quando listados em ordem crescente de peso atômico, semelhantes propriedades físicas e químicas retornavam em intervalos de oito, que ele comparou a oitavas de músicas.[16][17] Esta lei das oitavas, no entanto, foi ridicularizada por seus contemporâneos.[18]
O professor de química russo Dmitri Ivanovich Mendeleiev e Julius Lothar Meyer publicaram de forma independente as suas tabelas periódicas em 1869 e 1870, respectivamente. Ambos construíram suas tabelas de forma semelhante: listando os elementos de uma linha ou coluna em ordem de peso atômico e iniciando uma nova linha ou coluna quando as características dos elementos começavam a se repetir.[19] O sucesso da tabela de Mendeleiev surgiu a partir de duas decisões que ele tomou: a primeira foi a de deixar lacunas na tabela quando parecia que o elemento correspondente ainda não tinha sido descoberto.[20] Mendeleiev não fora o primeiro químico a fazê-lo, mas ele deu um passo adiante ao usar as tendências em sua tabela periódica para predizer as propriedades desses elementos em falta, como o gálio e o germânio.[21] A segunda decisão foi ocasionalmente ignorar a ordem sugerida pelos pesos atômicos e alternar elementos adjacentes, tais como o cobalto e o níquel, para melhor classificá-los em famílias químicas. Com o desenvolvimento das teorias de estrutura atômica, tornou-se aparente que Mendeleiev tinha, inadvertidamente, listado os elementos por ordem crescente de número atômico.[22]
Com o desenvolvimento das modernas teorias mecânica quânticas de configuração de elétrons dentro de átomos, ficou evidente que cada linha (ou período) na tabela correspondia ao preenchimento de um nível quântico de elétrons. Na tabela original de Mendeleiev, cada período tinha o mesmo comprimento. No entanto, como os átomos maiores têm subníveis, tabelas modernas têm períodos cada vez mais longos na parte de baixo.[23]
Em 1913, através do trabalho do físico inglês Henry G. J. Moseley, que mediu as frequências de linhas espectrais específicas de raios X de um número de 40 elementos contra a carga do núcleo (Z), pôde-se identificar algumas inversões na ordem correta da tabela periódica, sendo, portanto, o primeiro dos trabalhos experimentais a ratificar o modelo atômico de Bohr. O trabalho de Moseley serviu para dirimir um erro em que a química se encontrava na época por desconhecimento: até então os elementos eram ordenados pela massa atômica e não pelo número atômico.[12][24]
Nos anos que se seguiram após a publicação da tabela periódica de Mendeleiev, as lacunas que ele deixou foram preenchidas quando os químicos descobriram mais elementos químicos. O último elemento de ocorrência natural a ser descoberto foi o frâncio (referido por Mendeleiev como eka-césio) em 1939.[25] A tabela periódica também cresceu com a adição de elementos sintéticos e transurânicos. O primeiro elemento transurânico a ser descoberto foi o netúnio, que foi formado pelo bombardeamento de urânio com nêutrons num ciclotron em 1939.[26]
Estrutura da tabela periódica
| Grupo # | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| Período | ||||||||||||||||||||
| 1 | 1 H | 2 He | ||||||||||||||||||
| 2 | 3 Li | 4 Be | 5 B | 6 C | 7 N | 8 O | 9 F | 10 Ne | ||||||||||||
| 3 | 11 Na | 12 Mg | 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Ar | ||||||||||||
| 4 | 19 K | 20 Ca | 21 Sc | 22 Ti | 23 V | 24 Cr | 25 Mn | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn | 31 Ga | 32 Ge | 33 As | 34 Se | 35 Br | 36 Kr | ||
| 5 | 37 Rb | 38 Sr | 39 Y | 40 Zr | 41 Nb | 42 Mo | 43 Tc | 44 Ru | 45 Rh | 46 Pd | 47 Ag | 48 Cd | 49 In | 50 Sn | 51 Sb | 52 Te | 53 I | 54 Xe | ||
| 6 | 55 Cs | 56 Ba | * | 72 Hf | 73 Ta | 74 W | 75 Re | 76 Os | 77 Ir | 78 Pt | 79 Au | 80 Hg | 81 Tl | 82 Pb | 83 Bi | 84 Po | 85 At | 86 Rn | ||
| 7 | 87 Fr | 88 Ra | ** | 104 Rf | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds | 111 Rg | 112 Cn | 113 Nh | 114 Fl | 115 Mc | 116 Lv | 117 Ts | 118 Og | ||
| * Lantanídios | 57 La | 58 Ce | 59 Pr | 60 Nd | 61 Pm | 62 Sm | 63 Eu | 64 Gd | 65 Tb | 66 Dy | 67 Ho | 68 Er | 69 Tm | 70 Yb | 71 Lu | |||||
| ** Actinídios | 89 Ac | 90 Th | 91 Pa | 92 U | 93 Np | 94 Pu | 95 Am | 96 Cm | 97 Bk | 98 Cf | 99 Es | 100 Fm | 101 Md | 102 No | 103 Lr | |||||
Legenda da tabela
| Metais | Semimetais | Não metais | Desconhecidos | |||||||
| Metais alcalinos2 | Metais alcalinoterrosos2 | Metal de transição | Metais de transição2 | Metais representativos | Não metais | Halogênios3 | Gases nobres3 | |||
| Lantanídios1, 2 | Actinídios1, 2 | |||||||||
| Cor do número atômico: Estado físico (CNTP): | preto: sólido | verde: líquido | vermelho: gás | cinza: desconhecido |
| Cor e estilo da borda indica incidência na natureza: | elemento primordial | decaimento | elemento sintético |
A tabela periódica relaciona os elementos em linhas denominadas períodos e colunas chamadas grupos ou famílias, em ordem crescente de seus números atômicos (Z).
Grupo
Um grupo ou família é uma coluna vertical na tabela periódica. Os grupos normalmente têm mais tendências periódicas significativas do que os períodos ou blocos, explicados abaixo. A teoria da mecânica quântica moderna da estrutura atômica explica a tendência no grupo pela proposição que elementos dentro do mesmo grupo normalmente têm a mesma configuração eletrônica em sua camada de valência.[27] Consequentemente, elementos do mesmo grupo tendem a ter uma química compartilhada e exibir uma clara tendência em suas propriedades com o aumento do número atômico.[28] Entretanto, em algumas partes da tabela periódica, tais como no bloco d e bloco f, as similaridades horizontais podem ser tão importantes quanto, ou mais pronunciadas do que, as similaridades verticais.[29][30][31]
Sob a convenção internacional de nomenclatura, os grupos são numerados de 1 a 18 a partir da coluna à esquerda (os metais alcalinos) para à direita (os gases nobres).[32] Alguns dos grupos possuem nomes triviais não sistemáticos, conforme na tabela abaixo, embora raramente sejam utilizados. Os grupos do 3 ao 10 não possuem nomes triviais e são referidos simplesmente pelo número do grupo ou pelo nome do primeiro elemento do grupo (e.g. grupo do Escândio para os elementos do Grupo 3, uma vez que eles mostram menos similaridades e/ou tendências verticais.[32]
Elementos no mesmo grupo tendem a mostrar padrões no raio atômico, energia de ionização e eletronegatividade. Do topo para baixo, o raio atômico dos elementos aumenta. Uma vez que existem mais níveis energéticos preenchidos, a camada de valência eletrônica está mais afastada do núcleo. A partir do topo, cada elemento tem uma energia de ionização menor porque é mais fácil remover um elétron pois estão conectados com menos firmeza. De modo similar, a partir do topo, um grupo tem a eletronegatividade menor devido ao aumento da distância entre os elétrons de valência e o núcleo.[33] Porém, existem exceções nestas tendências como por exemplo nos elementos do Grupo 11 no qual a eletronegatividade aumenta a partir do topo dentro do grupo.[34]
Períodos
Um período é uma linha horizontal da tabela periódica. Embora os grupos tenham propriedades periódicas mais significativas, existem regiões onde a tendência horizontal é mais significativa do que a vertical, tais como no bloco f, onde os lantanídeos e actinídeos formam duas séries de grupos de elementos horizontais substanciais.[35]
Os elementos no mesmo período apresentam tendências no raio atômico, energia de ionização, afinidade eletrônica e eletronegatividade. Da esquerda para a direita, através do período, o raio atômico normalmente diminui. Isto acontece porque a cada elemento é adicionado um próton e um elétron, o que traz o elétron para mais perto do núcleo.[36] Esta diminuição do raio atômico também provoca o aumento da energia de ionização quando movendo da esquerda para a direita no período. Quanto mais firmemente conectado aos seus elétrons, mais energia é necessária para removê-los. A eletronegatividade aumenta da mesma maneira que a energia de ionização por causa da atração exercida nos elétrons pelo núcleo.[33] A afinidade eletrônica também possui uma leve tendência ao longo do período. Os metais à esquerda no período normalmente possuem uma afinidade eletrônica menor que os não metais à direita no período, com exceção dos gases nobres.[37]
Blocos
Regiões específicas da tabela periódica podem ser referidas como blocos em reconhecimento da sequência na qual as camadas eletrônicas dos elementos são preenchidas. Cada bloco é nomeado de acordo com a subcamada no qual o local fictício do "último" elétron.[notas 3] O bloco s compreende os dois primeiros grupos (metais alcalinos e alcalinos terrosos) assim como o hidrogênio e o hélio. O bloco p compreende os últimos seis grupos, que são os grupos 13 ao 18 na numeração da IUPAC e contém, entre outros elemento, todos os metaloides. O bloco d compreende os grupos 3 ao 12 e contém todos os metais de transição. O bloco f, às vezes mostrado abaixo do resto da tabela, não tem numeração de grupo e compreende os lantanídeos e actinídeos.[38]
Metais, metaloides e ametais
De acordo com as propriedades físicas e químicas, os elementos podem ser classificados em três categorias maiores de metais, metaloides e ametais. Os metais são geralmente brilhantes, sólidos, altamente condutores e formam ligas metálicas. Também formam compostos iônicos, como os sais, quando se juntam aos ametais, e hidretos, quando se juntam aos hidrogênios. A maioria dos ametais são coloridos e gases isolantes incolores; ametais que formam compostos com outros ametais apresentam ligações covalentes. Entre metais e não metais estão os metaloides, que possuem propriedades mistas ou intermediárias.[39]
O metal e ametal pode ser ainda classificado em subcategorias que demonstram uma graduação da propriedade metálica para a não metálica, quando indo da esquerda para a direita no período. Os metais são subdivididos em metais alcalinos, metais alcalinos terrosos, lantanídeos e actinídeos, através dos metais de transição, e terminando nos metais pós transição que são fracos quimicamente e fisicamente. Os ametais são simplesmente divididos nos ametais poliatômicos, que são essencialmente os ametais; e os gases nobres monoatômicos, que são não metais e praticamente inertes. Também são conhecidos grupos especializados tais como, por exemplo, os metais refratários e os metais nobres que são subconjuntos dos metais de transição[40] e são ocasionalmente destacados.[41]
A alocação dos elementos em categorias ou subcategorias baseada nas propriedades compartilhadas é imperfeita. Existe um espectro de propriedades dentro de cada categoria e não é difícil encontrar sobreposições nos limites, conforme acontece com a maioria dos esquemas de classificação.[42] O berílio, por exemplo, é classificado como um alcalino terroso embora sua química anfotérica e tendência a formar compostos covalentes seja característica dos metais pós-transição. O radônio ainda é classificado como um ametal e gás nobre embora possua química catiônica que é uma característica metálica. São possíveis outros esquemas de classificação tais como a divisão dos elementos nas categorias de ocorrência mineralógica ou nas estruturas cristalinas. A categorização dos elementos desta maneira iniciou em 1869 quando Hinrichs[43] escreveu que uma simples linha de limite poderia ser desenhada na tabela periódica para mostrar elementos que tem propriedades similares tais como os metais e ametais, ou os elementos gasosos.
Propriedades periódicas
Configuração eletrônica
A configuração eletrônica ou organização dos elétrons orbitando átomos neutros mostra um padrão recorrente ou periodicidade. Os elétrons ocupam uma série de níveis eletrônicos (numerados nível 1, nível 2, e assim em diante). Cada nível consiste de um ou mais subníveis (nomeados s, p, d, f e g). Conforme o número atômico aumenta, os elétrons progressivamente ocupam estes níveis e subníveis de acordo com o princípio de Aufbau ou regra de ordenamento energético, conforme demonstrado no diagrama. A configuração eletrônica para o neônio, por exemplo, é 1s² 2s² 2p6. Com o número atômico de dez, o neônio tem dois elétrons no primeiro nível e oito no segundo nível—dois ocupam o subnível s e seis o subnível p. Em termos de tabela periódica, a primeira vez que um elétron ocupa um novo nível corresponde ao início de um novo período, estas posições sendo ocupadas pelo hidrogênio e os metais alcalinos.[44][45]
Uma vez que as propriedades de um elementos são na maioria das vezes determinada pela configuração eletrônica, da mesma forma as propriedades dos elementos mostram um padrão recorrente ou periódico com alguns mostrados no diagrama abaixo para o raio atômico, energia de ionização e afinidade eletrônica. Foi esta periodicidade das propriedades, manifestação que foi bem observada antes da teoria atual ser estabelecida, que levou a formulação da lei periódica (as propriedades dos elementos recorrem em intervalos variados) e a formulação das primeiras tabelas periódicas.[44][45]
Raio atômico
O raio atômico varia de um modo previsível e explicável através da tabela periódica. Por exemplo, o raio geralmente diminui ao longo de cada período da tabela, a partir dos metais alcalinos para os gases nobres; e aumenta dentro do grupo de cima para baixo. O raio aumenta significativamente entre o gás nobre no fim de cada período e o metal alcalino no período seguinte. Esta propriedade (e de várias outras propriedades físicas e químicas dos elementos) pode ser explicada pela teoria da configuração eletrônica do átomo; elas fornecem evidências importantes para o desenvolvimento e confirmação da teoria quântica.[46]
Os elétrons no subnível 4f, que são progressivamente preenchidos a partir do Cério (elemento 58) até o Itérbio (elemento 70), não são efetivo na blindagem do aumento da carga nuclear para os subníveis posteriores. Os elementos subsequentes aos lantanídeos têm raio atômico que são menores do que o esperado e são quase idênticos ao raio atômico do elemento imediatamente acima destes.[47] Deste modo o Háfnio tem praticamente o raio atômico (e química) do zircônio, e o tântalo do nióbio e assim por diante. Este fenômeno é conhecido como contração dos lantanídeos. O efeito desta contração é visível até a platina (elemento 78), no qual após este é mascarado por efeitos relativísticos conhecidos como o efeito do par inerte.[48] A contração do bloco d, que é um efeito similar entre o bloco d e p, é menos pronunciado do que a contração dos lantanídeos mas ocorre pelo mesmo motivo.[47]
Energia de ionização
A primeira energia de ionização é a energia necessária para remover um elétron do átomo, a segunda energia de ionização é a energia necessária para remover um segundo elétron, e assim por diante. Para um dado átomo, a energia de ionização aumenta com o nível de remoção de elétrons. Para o magnésio, por exemplo, a primeira energia é de 738 kJ/mol e a segunda de 1 450 kJ/mol. Elétrons com orbitais mais próximos experimentam uma atração da força eletrostática maior, portanto é necessário mais energia para serem removidos. A Ionização fica ainda maior na parte superior à direita da tabela periódica.[48]
Saltos grandes na sucessão de energia de ionização molar ocorrem quando removendo um elétron numa configuração completa de nível eletrônico (gás nobre). Novamente, para o magnésio, para as duas primeiras energias de ionização dadas acima correspondem a remoção de dois elétrons 3s, e a terceira energia é de 7 730 kJ/mol que é muito superior pois remove um elétron do orbital 2p que tem configuração similar ao do neon para o Mg2+. Saltos similares correm em energias de ionização de átomos no terceiro período.[48]
Eletronegatividade
A eletronegatividade é a tendência de um átomo de atrair um elétron.[49] Proposta inicialmente por Linus Pauling em 1932, é afetada tanto pelo número atômico quanto pela distância entre os elétrons de valência e o núcleo.[50] Em geral, ela aumenta da esquerda para direita ao longo do período, e de baixo para cima no grupo. Portanto, o flúor é o elemento mais eletronegativo,[notas 5] enquanto o césio é o com menor valor, pelo menos entre os elementos com dados substanciais.[34]
Existem algumas exceções para esta regra geral. O gálio e o germânio têm eletronegatividades superiores ao alumínio e silício, respectivamente, devido a contração do bloco d. Elementos do quarto período imediatamente após a primeira linha dos metais de transição têm um raio atômico surpreendentemente pequeno porque os elétrons 3d não são efetivos na blindagem do aumento da carga nuclear, e volumes atômicos menores implicam em uma eletronegatividade superior.[34] O chumbo tem uma eletronegatividade superior anômala, particularmente quando comparado com o tálio e o bismuto, que parece ser um artifício da seleção de dados e métodos de cálculo disponível ao invés do método de Pauling de mostrar a tendência periódica destes elementos.[51]
Afinidade eletrônica
A afinidade eletrônica de um átomo é a quantidade de energia envolvida quando um elétron é adicionado a um átomo no estado gasoso. Embora a afinidade eletrônica varie consideravelmente, existem alguns padrões periódicos. Geralmente, ametais têm valores de afinidade eletrônica positivos superiores aos dos metais. O cloro atrai com mais força o elétron extra, e os gases nobres não tiveram seus dados mensurados de forma conclusiva portanto podem ter ou não um valor levemente negativo.[54]
A afinidade eletrônica geralmente aumenta dentro de um período. Isto é causado pelo preenchimento do camada de valência do átomo; um átomo do grupo 17 libera mais energia do que um do grupo 1 ao ganhar um elétron porque preenche esta camada e então se torna mais estável.[54]
Dentro do grupo, a afinidade eletrônica diminui com o aumento do número de períodos. O elétron extra estaria entrando em um orbital mais afastado do núcleo e como tal seria menos atraído pelo núcleo liberando menos energia quando adicionado. Todavia, com o aumento do número do período, aproximadamente um terço dos elementos são anômalos, com os elementos mais pesados tendo uma afinidade eletrônica maior que os congêneres mais leves. Isto se deve a blindagem ineficiente dos elétrons nos níveis d e f. Uma diminuição uniforme da afinidade eletrônica só é aplicável aos átomos do grupo 1.[55]
Característica metálica
Quanto menor os valores de energia de ionização, eletronegatividade e afinidade eletrônica, maior a característica metálica do elemento. De modo contrário, a característica não metálica aumenta com os valores destas propriedades.[56] Dada a tendência periódica destas propriedades, a característica metálica tende a diminuir ao longo do período e, com algumas irregularidades devido ao fraco efeito de blindagem dos elétrons f e d e efeitos relativísticos,[57] tende a aumentar ao longo do grupo (ou coluna ou família). Deste modo, os elementos mais metálicos (tais como o césio e o frâncio) são encontrados na parte de baixo à esquerda de uma tabela periódica tradicional e os elementos mais ametálicos (oxigênio, flúor e cloro no topo à direita. A combinação das tendências horizontais e verticais na característica metálica explica o formato em escada da linha dividindo os metais e ametais que é encontrada em algumas tabelas, e a prática de categorizar vários elementos adjacentes nesta linha, ou elementos adjacentes a estes elementos como metaloides.[58][59]
Tabelas periódicas diferentes
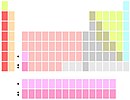
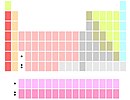
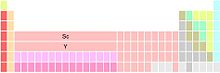
Variação dos constituintes do grupo 3
La e Ac abaixo do Y |
Existem três variações principais da tabela periódica, cada uma diferindo na constituição dos elementos do grupo 3. O escândio e o ítrio são mostrados como os dois primeiros membros deste grupo; e a diferença depende da identidade dos membros remanescentes.[60]
Grupo 3 é o Sc, Y, e La, Ac. O lantânio (La) e o actínio (Ac) ocupam as duas posições abaixo do ítrio, sendo esta a variante mais comum.[61][notas 6] Isto enfatiza as similaridades nas propriedades periódicas ao descer nos grupos 1, 2 e 3, ao custo de descontinuidades na propriedades entre os grupos 3 e 4 e fragmentando os lantanídeos e actinídeos.[notas 7]
Lu e Lr abaixo do Y |
Group 3 é o Sc, Y, e Lu, Lr. O lutécio (Lu) e o laurêncio (Lr) ocupam as duas posições abaixo do ítrio. Esta variante mantém as quatorze colunas do bloco f e fragmenta os lantanídeos e actinídeos. Isto enfatiza as similaridades nas propriedades periódicas entre o grupo 3 e os seguintes ao custo de descontinuidades nas propriedades entre o grupo 2 e 3.[notas 8]
Marcadores abaixo do Y |
Grupo 3 é o Sc, Y, e 15 lantanídeos e 15 actinídeos. As duas posições abaixo do ítrio contêm os lantanídeos e actinídeos (possivelmente um marcador de nota de rodapé). Esta variação enfatiza as similaridades na química dos elementos lantanídeos (La–Lu), ao custo da ambiguidade no qual os elementos que ocupam o grupo 3 abaixo do ítrio parecem ser uma coluna de 15 blocos f (podem existir somente 14 elementos em uma linha do bloco f).[notas 9]
Estas três variações são originadas da dificuldade histórica de colocar os lantanídeos na tabela periódica, e argumentos como onde os elementos do bloco f começam e terminam.[62][notas 10] Tem sido questionado que tais argumentos são uma prova de que, é um erro separar o sistema periódico em blocos delimitados. [63] Do mesmo modo, algumas versões com os dois marcadores tem sido criticadas por implicar que todos os quinze lantanídeos ocupam uma única célula ou estão abaixo do ítrio,[64][notas 11] em desacordo com o princípio básico de um elemento para cada espaço na tabela.[nota 1] A controvérsia de quais elementos ocupam o grupo 3 abaixo do escândio e Ítrio é discutida na seção Questões abertas e controvérsias do artigo.
A tabela com o Lu e o Lr é mostrada no início e na visão geral deste artigo. Quando comparado com a variante do La e Ac, aparentemente existem poucas exceções ao preenchimento dos orbitais 4f entre os membros subsequentes das séries.[65][notas 12]
Ver também
Notas
- ↑ Habashi tenta corrigir esta objeção ao colocar os lantanídeos em uma torre se levantando da tabela periódica embaixo do ítrio (em uma direção perpendicular ao plano da tabela). See: Habashi F. (2015). "A New Look at the Periodic Table". European Chemical Bulletin 4(1): 1–7 (see p. 5).
- ↑ Os elementos descobertos inicialmente por síntese e posteriormente na natureza são o Tecnécio (Z=43), Promécio (61), Astatino (85), Netúnio (93) e o Plutônio (94).
- ↑ Um elemento zero (i.e. uma substância composta puramente de nêutrons), está incluído em algumas representações alternativas como, por exemplo, na galáxia química.
- ↑ Existe uma inconsistência e algumas irregularidades nesta convenção. Assim, o hélio é mostrando no bloco p ao invés do bloco s, e (por exemplo) a subcamada d no bloco d é na verdade preenchida quando o grupo 11 é alcançado, ao invés do grupo 12.
- ↑ Os gases nobres, astatino, frâncio e todos os elementos mais pesados que o Amerício foram deixados de fora uma vez que não há dados disponíveis para eles.
- ↑ Enquanto o flúor é o elemento mais eletronegativo na escala de Pauling, o neônio é o mais eletronegativo em outras escalas, tais como na escala de Allen.
- ↑ Clark e White realizaram uma pesquisa para determinar as tendências nas tabelas periódicas de livros textos de 1948 a 2008. Em 35 livros textos encontraram onze tipo I, nove tipo II e nove tipo III. Ao longo dos últimos 20 anos de sua pesquisa a contagem foi nove tipo I, nove tipo II e duas tipo III. Ver: Clark R. W. & White G. D. (2008). "The flyleaf periodic table". Journal of Chemical Education. 85(4): 497.
- ↑ Para exemplos da tabela tipo I ver Atkins et al. (2006). Shriver & Atkins Inorganic Chemistry (4th ed.). Oxford: Oxford University Press • Myers et al. (2004). Holt Chemistry. Orlando: Holt, Rinehart & Winston • Chang R. (2000). Essential Chemistry(2nd ed.). Boston: McGraw-Hill
- ↑ Para exemplos da tabela Grupo 3=Sc,Y,Lu,Lr ver Rayner-Canham G. & Overton T. (2013). Descriptive Inorganic Chemistry(6th ed.). New York: W. H. Freeman and Company • Brown et al. (2009). Chemistry: The Central Science (11th ed.). Upper Saddle River, New Jersey: Pearson Education • Moore et al. (1978). Chemistry. Tokyo: McGraw-Hill Kogakusha
- ↑ Para exemplos desta tabela ver Housecroft C. E. & Sharpe A. G. (2008). Inorganic Chemistry (3rd ed.). Harlow: Pearson Education • Halliday et al. (2005). Fundamentals of Physics (7th ed.). Hoboken, NewJersey: John Wiley & Sons • Nebergall et. al. (1980). General Chemistry (6th ed.). Lexington: D. C. Heath and Company
- ↑ A separação dos lantanídeos da parte principal da tabela tem sido atribuída ao químico Bohuslav Brauner que, em 1902, colocou todos os elementos (("Ce etc.") em uma posição no grupo 4, abaixo do zircônio. Este arranjo é referido como a "hipótese asteróide ", em analogia aos asteroides que ocupam uma órbita única no sistema solar. Antes desta época os lantanídeos eram geralmente colocados ao longo dos grupos 1 ao 8 da antiga forma de 8 colunas da tabela periódica. Embora existam registro do arranjo de Brauner já por volta de 1895, ele é conhecido por se referir a "química dos asteróides " em 1881 em um carta para Mendeleev. Outros autores ordenaram os lantanídeos tanto no grupo 3, grupos 3 e 4, ou grupos 2,3 e 4. Em 1992, Niels Bohr continuou o processo de destacamento dos lantanídeos ao posicioná-los entre os blocos d e s. Em 1949, Glenn T. Seaborg reintroduziu a forma que é popular na atualidade, em que os lantanídeos e actinídeos aparecem como notas de rodapé. A primeira publicação da tabela de Seaborg foi em um relatório confidencial datado de 1944. Foi publicada novamente por ele em 1945 no periódico Chemical and Engineering News e nos anos seguintes até 1949 diversos autores a comentaram e concordaram com sua proposta. Neste ano ele notou que o melhor modo de representar os actinídeos parecia ser posicionando-os abaixo da tabela, e por analogia, os lantanídeos. Ver: Thyssen P. and Binnemans K. (2011). "Accommodation of the Rare Earths in the Periodic Table: A Historical Analysis". In K. A. Gschneider Jr. (ed). Handbook on the Physics and Chemistry of the Rare Earths. 41. Amsterdam: Elsevier, pp. 1–94; Seaborg G. T. (1994). Origin of the Actinide Concept'. In K. A. Gschneider Jr. (ed). Handbook on the Physics and Chemistry of the Rare Earths. 18. Amsterdam: Elsevier, pp. 1–27.
- ↑ Jensen escreveu: Os dois espaços abaixo do Sc e Y… contêm nem os números atômicos de 57 a 71 e 89 a 103 ou os símbolos La-Lu e Ac-Lr, respectivamente, assim indicando que todos os trinta elementos pertencem a estes espaços. Expandir a tabela para uma com 32 colunas iria requerer o alongamento do espaço do Sc e Y de modo que eles iriam cobrir todas as quinze colunas inseridas
- ↑ Para as tabelas periódicas do La e Ac e do Lu e Lr, as duas tabelas a seguir comparam o número idealizado de elétrons "f" para os elementos do período 6 e 7 no bloco f com seus números reais de elétrons "f". Existem 20 irreguladiras na primeira tabela em comparação com nove na segunda. TABELA 1: tabela periódica Sc-Y-La-Ac
Period 6 Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu elétrons f idealizados 1 2 3 4 5 6 7 8 9 10 11 12 13 14 número real 1 3 4 5 6 7 7 9 10 11 12 13 14 14 Período 7 Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Número atual 0 2 3 4 6 7 7 9 10 11 12 13 14 14 TABELA 2: tabela períodica Sc-Y-Lu-Lr com a configuração eletrônica do bloco f
(sombra em cinza claro = número de elétrons f é parelho; sombra em cinza escuro = irregularidade)
Período 7 La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb elétrons f idealizados 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Número atual 0 1 3 4 5 6 7 7 9 10 11 12 13 14 Período 7 Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Número atual 0 0 2 3 4 6 7 7 9 10 11 12 13 14 Para o número de elétrons idealizados na Tabela 1, ver: Newell, S. B. (1977). Chemistry: An Introduction. Boston: Little, Brown and Company, p. 196. Para a Tabela 2, ver: Brown et al. (2009). Chemistry: The Central Science (11ed.). Upper Saddle River, New Jersey: Pearson Education, pp. 207, 208–210. Em ambos os casos as contagens são consistentes com a configuração padrão para elementos do bloco f de [Gás nobre] (n–2)f xns² onde n = o número do período e x = um inteiro de 1 a 14. Ver: Rouvray D. H. (2015). "The Surprising Periodic Table: Ten Remarkable Facts". In B. Hargittai & I. Hargittai (eds). Culture of Chemistry: The Best Articles on the Human Side of 20th-Century Chemistry from the Archives of the Chemical Intelligencer. New York: Springer Science+Business Media, pp. 183–193 (190).
Referências
- ↑ «Chemistry: Four elements added to periodic table». BBC News
- ↑ a b Emsley, J. (2011). Nature's Building Blocks: An A-Z Guide to the Elements New ed. New York, NY: Oxford University Press. ISBN 978-0-19-960563-7
- ↑ «The United Nations Proclaims the International Year of the Periodic Table of Chemical Elements - IUPAC | International Union of Pure and Applied Chemistry». IUPAC | International Union of Pure and Applied Chemistry(em inglês). 28 de dezembro de 2017
- ↑ Greenwood & Earnshaw, pp. 24–27
- ↑ Gray, p. 6
- ↑ CNN, Ashley Strickland. «New elements on the periodic table are named». CNN. Consultado em 11 de junho de 2016
- ↑ «Discovery and assignment of elements with atomic numbers 113, 115, 117 and 118». International Union of Pure and Applied Chemistry. 30 de dezembro de 2015
- ↑ «Escolhidos os nomes dos novos elementos da tabela periódica». Revista Pesquisa FAPESP. Consultado em 11 de julho de 2016
- ↑ «Hello, Nihonium. Scientists Name 4 New Elements On The Periodic Table». NPR.org. Consultado em 11 de junho de 2016
- ↑ Silva, Robert J. (2006). «Fermium, Mendelevium, Nobelium and Lawrencium». In: Morss, L.R.; Edelstein, N.M.; Fuger, J. The Chemistry of the Actinide and Transactinide Elements 3rd ed. Dordrecht, The Netherlands: Springer Science+Business Media. ISBN 1-4020-3555-1
- ↑ a b Rouvray, Dennis H. (2004). «Elements in the history of the Periodic Table» 2 ed. Endeavour. 28: 69-74. doi:10.1016/j.endeavour.2004.04.006. ISSN 0160-9327Parâmetro desconhecido
|lang2=ignorado (|lingua=) sugerido (ajuda) - ↑ a b Tolentino, Mario; ROCHA-FILHO, Romeu C.; CHAGAS, Aécio Pereira (1997). «Alguns aspectos históricos da classificação periódica dos elementos químicos» (PDF) 1 ed. Química Nova. 20: 103-117. ISSN 0100-4042
- ↑ a b Ball, p. 100
- ↑ Horvitz, Leslie (2002). Eureka!: Scientific Breakthroughs That Changed The World. New York: John Wiley. p. 43. ISBN 978-0-471-23341-1. OCLC 50766822
- ↑ Ball, p. 101
- ↑ Newlands, John A. R. (20 de agosto de 1864). «On Relations Among the Equivalents». Chemical News. 10: 94–95
- ↑ Newlands, John A. R. (18 de agosto de 1865). «On the Law of Octaves». Chemical News. 12: 83
- ↑ Bryson, Bill (2004). A Short History of Nearly Everything. London: Black Swan. pp. 141–142. ISBN 9780552151740
- ↑ Ball, pp. 100–102
- ↑ Pullman, p. 227
- ↑ Ball, p. 105
- ↑ Atkins, p. 87
- ↑ Ball, p. 111
- ↑ N.D. Epiotis, D.K. Henze (2003). Encyclopedia of Physical Science and Technology Terceira ed. pp. 671–695
- ↑ Adloff, Jean-Pierre; Kaufman, George B. (2005-09-25). Francium (Atomic Number 87), the Last Discovered Natural Element Arquivado em 4 de junho de 2013, no Wayback Machine.. The Chemical Educator 10 (5). Página acessada em 26-03-2007.
- ↑ Ball, p. 123
- ↑ Scerri 2007, p. 24
- ↑ Messler, R. W. (2010). The essence of materials for engineers. Sudbury, MA: Jones & Bartlett Publishers. p. 32. ISBN 0-7637-7833-8
- ↑ Bagnall, K. W. (1967). «Recent advances in actinide and lanthanide chemistry». In: Fields, P.R.; Moeller, T. Advances in chemistry, Lanthanide/Actinide chemistry. Col: Advances in Chemistry. 71. [S.l.]: American Chemical Society. pp. 1–12. ISBN 0-8412-0072-6. doi:10.1021/ba-1967-0071.
- ↑ Day, M. C., Jr.; Selbin, J. (1969). Theoretical inorganic chemistry 2nd ed. New York: Nostrand-Rienhold Book Corporation. p. 103. ISBN 0-7637-7833-8
- ↑ Holman, J.; Hill, G. C. (2000). Chemistry in context 5th ed. Walton-on-Thames: Nelson Thornes. p. 40. ISBN 0-17-448276-0
- ↑ a b Leigh, G. J. (1990). Nomenclature of Inorganic Chemistry: Recommendations 1990. [S.l.]: Blackwell Science. ISBN 0-632-02494-1
- ↑ a b Moore, p. 111
- ↑ a b c Greenwood & Earnshaw, p. 30
- ↑ Stoker, S. H. (2007). General, organic, and biological chemistry. New York: Houghton Mifflin. p. 68. ISBN 978-0-618-73063-6. OCLC 52445586
- ↑ Mascetta, J. (2003). Chemistry The Easy Way 4th ed. New York: Hauppauge. p. 50. ISBN 978-0-7641-1978-1. OCLC 52047235
- ↑ Kotz, J.; Treichel, P.; Townsend, John (2009). Chemistry and Chemical Reactivity, Volume 2 7th ed. Belmont: Thomson Brooks/Cole. p. 324. ISBN 978-0-495-38712-1. OCLC 220756597
- ↑ Jones, C. (2002). d- and f-block chemistry. New York: J. Wiley & Sons. p. 2. ISBN 978-0-471-22476-1. OCLC 300468713
- ↑ Silberberg, M. S. (2006). Chemistry: The molecular nature of matter and change 4th ed. New York: McGraw-Hill. p. 536. ISBN 0-07-111658-3
- ↑ Manson, S. S.; Halford, G. R. (2006). Fatigue and durability of structural materials. Materials Park, Ohio: ASM International. p. 376. ISBN 0-87170-825-6
- ↑ Bullinger, H-J. (2009). Technology guide: Principles, applications, trends. Berlin: Springer-Verlag. p. 8. ISBN 978-3-540-88545-0
- ↑ Jones, B. W. (2010). Pluto: Sentinel of the outer solar system. Cambridge: Cambridge University Press. pp. 169–71. ISBN 978-0-521-19436-5
- ↑ Hinrichs, G. D. (1869). «On the classification and the atomic weights of the so-called chemical elements, with particular reference to Stas's determinations». Proceedings of the American Association for the Advancement of Science. 18 (5): 112–124
- ↑ a b Myers, R. (2003). The basics of chemistry. Westport, CT: Greenwood Publishing Group. pp. 61–67. ISBN 0-313-31664-3
- ↑ a b Chang, R. (2002). Chemistry 7 ed. New York: McGraw-Hill. pp. 289–310; 340–42. ISBN 0-07-112072-6
- ↑ Greenwood & Earnshaw, p. 27
- ↑ a b Jolly, W. L. (1991). Modern Inorganic Chemistry 2nd ed. [S.l.]: McGraw-Hill. p. 22. ISBN 978-0-07-112651-9
- ↑ a b c Greenwood & Earnshaw, p. 28
- ↑ IUPAC, Compêndio de Terminologia Química, 2ª ed. ("Gold Book"). Compilado por A. D. McNaught e A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Versão online: "{{{título}}}" (2006–) criado por M. Nic, J. Jirat, B. Kosata; atualizações compiladas por A. Jenkins. ISBN 0-9678550-9-8.
- ↑ Pauling, L. (1932). «The Nature of the Chemical Bond. IV. The Energy of Single Bonds and the Relative Electronegativity of Atoms». Journal of the American Chemical Society. 54 (9): 3570–3582. doi:10.1021/ja01348a011
- ↑ Allred, A. L. (1960). «Electronegativity values from thermochemical data». Northwestern University. Journal of Inorganic and Nuclear Chemistry. 17 (3–4): 215–221. doi:10.1016/0022-1902(61)80142-5. Consultado em 11 de junho de 2012
- ↑ Huheey, Keiter & Keiter, p. 42
- ↑ Siekierski, S.; Burgess, J. (2002). Concise chemistry of the elements. Chichester: Horwood Publishing. pp. 35‒36. ISBN 1-898563-71-3
- ↑ a b Chang, pp. 307–309
- ↑ Huheey, Keiter & Keiter, pp. 42, 880–81
- ↑ Yoder, C. H.; Suydam, F. H.; Snavely, F. A. (1975). Chemistry 2nd ed. [S.l.]: Harcourt Brace Jovanovich. p. 58. ISBN 0-15-506465-7
- ↑ Huheey, Keiter & Keiter, pp. 880–85
- ↑ Sacks, O (2009). Uncle Tungsten: Memories of a chemical boyhood. New York: Alfred A. Knopf. pp. 191, 194. ISBN 0-375-70404-3
- ↑ Gray, p. 9
- ↑ Clark, R.W.; White, G.D. (2008). «The Flyleaf Periodic Table». Journal of Chemical Education. 85 (4): 497. Bibcode:2008JChEd..85..497C. doi:10.1021/ed085p497
- ↑ Myers, R.T.; Oldham, K.B.; S., Tocci (2004). Holt Chemistry. Orlando: Holt, Rinehart and Winston. p. 130. ISBN 0-03-066463-2
- ↑ Thyssen, P.; Binnemans, K (2011). Gschneidner Jr., K.A.; Bünzli, J-C.G; Vecharsky, Bünzli, eds. Accommodation of the Rare Earths in the Periodic Table: A Historical Analysis. Handbook on the Physics and Chemistry of Rare Earths. 41. Amsterdam: Elsevier. pp. 1–94. ISBN 978-0-444-53590-0
- ↑ Stewart, P.J. (2008). «The Flyleaf Table: An Alternative». Journal of Chemical Education. 85 (11): 1490. Bibcode:2008JChEd..85.1490S. doi:10.1021/ed085p1490
- ↑ Jensen, WB (2008). «The Periodic Table: Facts or Committees?». Journal of Chemical Education. 85 (11): 1491–1492. Bibcode:2008JChEd..85.1491J. doi:10.1021/ed085p1491.2
- ↑ Brown, T. L.; LeMay Jr, H. E; Bursten, B. E. (2009). Chemistry: The Central Science 11 ed. Upper Saddle River, New Jersey: Pearson Education. pp. 207, 208–210. ISBN 9780132358484
Bibliografia
- Atkins, P. W. (1995). The Periodic Kingdom. [S.l.]: HarperCollins Publishers, Inc. ISBN 0-465-07265-8
- Ball, Philip (2002). The Ingredients: A Guided Tour of the Elements. [S.l.]: Oxford University Press. ISBN 0-19-284100-9
- Brown, Theodore L.; LeMay, H. Eugene; Bursten, Bruce E. (2005). Chemistry:The Central Science 10th ed. [S.l.]: Prentice Hall. ISBN 0-13-109686-9
- Pullman, Bernard (1998). The Atom in the History of Human Thought. [S.l.]: Oxford University Press. ISBN 0-19-515040-6