Câncer
| Câncer | |
|---|---|
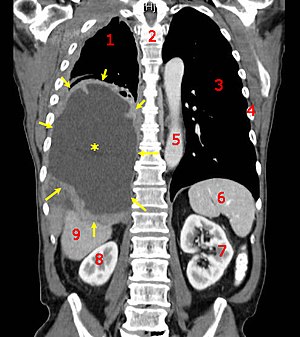
| Tomografia computadorizada mostrando um mesotelioma maligno. 1 & 3, pulmões, 2 espinha dorsal, 4 costelas, 5 aorta, 6 baço, 7 & 8 rins e 9 fígado | |
| Especialidade | oncologia |
| Classificação e recursos externos | |
| CID-10 | C80, C80.1 |
| CID-9 | 199 |
| ICD-O: | 8000/3 |
| DiseasesDB | 28843 |
| MedlinePlus | 001289 |
Câncer (português brasileiro) ou cancro (português europeu), também conhecido como neoplasia maligna, é um grupo de doenças que envolvem o crescimento celular anormal, com potencial para invadir e espalhar-se para outras partes do corpo, além do local original.[1][2] Há mais de cem diferentes cânceres conhecidos que afetam os seres humanos,[2] mas nem todos os tumores são cancerosos (malignos); tumores benignos não se espalham pelo corpo.[2] Sinais e sintomas possíveis incluem surgimento de uma massa cancerígena, sangramento anormal, tosse prolongada, perda de peso inexplicável, mudança nas funções intestinais, entre outros.[3] Apesar de estes sintomas poderem indicar câncer, eles também podem ocorrer devido a outras doenças.[3]
O uso do tabaco é a causa de cerca de 22% das mortes, evitáveis, por câncer.[1][4] Outros 10% ocorrem devido à obesidade, uma dieta pobre, falta de atividade física e consumo de bebidas alcoólicas.[1][5] Entre outros, estão certos tipos de infecções, exposição à radiação ionizante e poluentes ambientais.[6] No mundo em desenvolvimento, cerca de 20% dos cânceres surgem devido a infecções, tais como hepatite B, hepatite C e vírus do papiloma humano (HPV).[1] Estes fatores atuam, pelo menos parcialmente, na alteração dos genes das células.[7] Normalmente muitas dessas mudanças são necessárias para que o câncer se desenvolva.[7] Entre 5% e 10% dos cânceres surgem por conta de defeitos genéticos hereditários.[8] O câncer pode ser detectado através de certos sinais e sintomas ou por meio de testes de rastreio.[1] Em seguida, geralmente é feita a investigação por imagens médicas e a confirmação pela biópsia.[9] Os benefícios do rastreio do câncer de mama ainda são controversos,[10][11] mas a detecção precoce através de mamografia é útil para o câncer do colo do útero e colorretal.[10]
Muitos cânceres podem ser evitados ao: manter um peso ideal, comer muitos vegetais, frutas e grãos integrais, ser vacinado contra certas doenças infecciosas, não comer muita carne vermelha processada, evitar ingestão excessiva de álcool, de fumo e demasiada exposição à luz solar.[12][13] O câncer é frequentemente tratado através da combinação de radioterapia, cirurgia, quimioterapia e terapia dirigida.[1][14] A gestão da dor e dos sintomas é uma parte importante do tratamento. Os cuidados paliativos são particularmente importantes para os doentes com cânceres em estágios avançados.[1] A chance de sobrevivência depende do tipo de câncer e da extensão da doença no início do tratamento.[7] Em crianças menores de quinze anos no momento do diagnóstico a taxa de sobrevivência de cinco anos no mundo desenvolvido é, em média, de 81%.[15] Nos Estados Unidos a taxa média de sobrevivência de cinco anos é de 66%.[16]
Em 2012, cerca de 14,1 milhões de novos casos de câncer ocorreram globalmente (excluindo casos de câncer de pele que não seja melanoma).[7] A doença causou cerca de 8,2 milhões de mortes, ou 14,6% de todas as mortes humanas,[7][17] além de um prejuízo anual de 2 trilhões de dólares na economia mundial (dados de 2015).[18][19] Os tipos mais comuns de câncer nos homens são de pulmão, próstata, colorretal e de estômago. Nas mulheres, os tipos mais comuns são o câncer de mama, colorretal, de pulmão e cervical.[7] Se o câncer de pele que não for melanoma for incluído no total de novos casos anuais, ele representará cerca de 40% dos registros da doença.[20][21] Em crianças, leucemia linfoide aguda e tumores cerebrais agudos são os mais comuns, exceto na África, onde o linfoma não Hodgkin ocorre com mais frequência.[15] Em 2012, cerca de 165 mil crianças com menos de quinze anos de idade foram diagnosticadas com câncer. O risco de câncer aumenta significativamente com a idade e muitos cânceres ocorrem mais comumente em países desenvolvidos devido à mudança no estilo de vida e à chegada da terceira idade.[7][22][23]
Etimologia
A palavra "Câncer" em português brasileiro é oriunda do latim cancer, em português: caranguejo,[24] em referência à proliferação de células cancerosas no organismo (metástase), que se espalham pelo corpo de forma semelhante às patas e pinças do caranguejo que irradiam do seu cefalotórax. Em português europeu, o termo cancro é oriundo do latim cancru.[25]
Sinais e sintomas
Quando o câncer começa, invariavelmente, não produz sintomas. Sinais e sintomas só aparecem quando a massa cancerígena continua a crescer ou forma úlceras e dependem do tipo e da localização do câncer. Alguns sintomas são específicos, sendo que muitos deles também ocorrem com frequência em indivíduos que têm outras patologias. O câncer é o novo "grande imitador", assim, não é incomum que pessoas diagnosticadas com câncer recebam patologia de outras doenças com sintomas semelhantes.[26]
Efeitos locais
A massa do tumor (ou a ulceração) podem causar sintomas locais. Por exemplo, os efeitos da massa cancerígena no pulmão podem causar a obstrução do brônquio, o que resulta em tosse ou pneumonia; se ocorrer no pulmão pode causar hemorragia, fazendo com que o paciente passe a tossir sangue; o câncer de esôfago pode causar o estreitamento do esôfago, o que torna o ato de engolir difícil ou doloroso; nos intestinos a hemorragia causa anemia ou hemorragia retal; o câncer colorretal pode levar ao estreitamento ou bloqueio do intestino, o que altera as funções intestinais; na bexiga a ulceração causa a presença de sangue na urina; no útero, a hemorragia vaginal. A massa inicial é geralmente indolor, porém em estádios avançados podem ocorrer dores localizadas. Alguns tipos de câncer podem causar acumulação de líquido dentro do peito ou no abdômen.[26]
Sintomas sistêmicos
Os sintomas gerais ocorrem devido a efeitos distantes do câncer que não estão relacionados à propagação metastática, o que pode incluir: perda involuntária de peso, febre, cansaço excessivo e alterações na pele.[27] A doença de Hodgkin, leucemias e câncer de fígado ou rins podem causar uma febre de origem desconhecida persistente.[26]
Alguns tipos de câncer podem causar grupos específicos de sintomas sistêmicos, denominados fenômenos para-neoplásicos, como o aparecimento de miastenia grave na timoma ou hipocratismo digital no câncer de pulmão.[26]
Metástase
O câncer pode se espalhar a partir do seu local original de propagação através da disseminação linfática para os linfonodos regionais, ou pelo sangue para locais distantes, processo conhecido como metástase. Quando o câncer se espalha por uma rota sanguínea, normalmente se espalha por todo o corpo. No entanto, "sementes" de câncer crescem em determinados locais. Os sintomas de cânceres metastáticos dependem da localização do tumor e podem incluir linfadenopatia, hepatomegalia ou esplenomegalia, dor ou fratura dos ossos afetados, além de sintomas neurológicos.[26]
Causas
A grande maioria dos cânceres, cerca de 90-95% dos casos, ocorre devido a fatores ambientais. Os 5-10% restantes são devido à hereditariedade genética.[6] Os fatores ambientais englobam qualquer causa que não seja herdada geneticamente, como o estilo de vida, nível econômico e fatores comportamentais, e não apenas a poluição.[28] Entre os principais fatores ambientais que contribuem para a morte por câncer estão o tabagismo (25-30%), maus hábitos alimentares e obesidade (30-35%), além de infecções (15-20%), radiação (tanto ionizante e não ionizante, até 10%), estresse, sedentarismo e poluentes ambientais.[6]
É praticamente impossível determinar a causa de um câncer em dada pessoa, uma vez que a maioria dos cânceres têm várias causas possíveis. Por exemplo, se um fumador desenvolver câncer de pulmão, é provável que a doença tenha sido causada pelo tabagismo; mas visto que qualquer pessoa apresenta uma pequena probabilidade de desenvolver câncer de pulmão, como resultado da poluição do ar ou da radiação, há uma pequena probabilidade de esse câncer ter sido causado por outros fatores. Apesar de muito raramente poderem ocorrer transmissões durante a gravidez e em alguns doadores de órgãos, o câncer geralmente não é uma doença transmissível.[29]
Produtos químicos
A exposição a determinadas substâncias tem sido associada a tipos específicos de câncer. Estas substâncias são denominadas cancerígenas. O tabagismo, por exemplo, é a causa de 90% dos casos de câncer de pulmão,[30] podendo ser também a causa de câncer de laringe, cabeça e pescoço, estômago, bexiga, rins, esôfago e pâncreas.[31] O fumo do tabaco contém mais de 50 agentes cancerígenos conhecidos, incluindo nitrosaminas e hidrocarbonetos aromáticos policíclicos.[32] O tabaco é responsável por cerca de uma em cada três mortes por câncer no mundo desenvolvido[33] e cerca de uma em cada cinco mortes em todo o mundo.[32] As taxas de mortalidade por câncer de pulmão nos Estados Unidos têm espelhado padrões, com o aumento de fumantes seguido por aumentos dramáticos nas taxas de mortalidade por câncer de pulmão. No entanto, a diminuição nas taxas de tabagismo desde a década de 1950 levou a decréscimos nas taxas de mortalidade por câncer de pulmão em homens desde os anos 1990.[34][35]
Na Europa Ocidental, 10% dos cânceres em homens e 3% de todos os cânceres em mulheres são atribuídos à exposição ao álcool, especialmente em casos de câncer do fígado e do trato digestivo.[36] Acredita-se que o câncer relacionado à exposição a substâncias no local de trabalho possa representar entre 2% e 20% de todos os casos.[37] Todos os anos, pelo menos 200 mil pessoas morrem de câncer no mundo em casos relacionados a seus locais de trabalho.[38] Milhões de trabalhadores correm o risco de desenvolver a doença, como câncer de pulmão e mesotelioma, por inalação do fumo do tabaco ou de fibras de amianto no trabalho, ou leucemia por exposição ao benzeno.[38]
Dieta e sedentarismo
Os maus hábitos alimentares, o sedentarismo e a obesidade estão relacionados com 30% a 35% das mortes por câncer.[6][39] O excesso de peso corporal nos Estados Unidos está associado ao desenvolvimento de muitos tipos de câncer e é um fator relevante entre 14% e 20% de todas as mortes por câncer.[39] Do mesmo modo, um estudo do Reino Unido, que incluiu dados de mais de 5 milhões de pessoas, apresentou que um maior índice de massa corporal (IMC) está relacionado a pelo menos dez tipos de câncer e é responsável por cerca de 12 mil casos anuais da doença no país.[40] Acredita-se que o sedentarismo possa contribuir para o risco de câncer, não só através do seu efeito sobre o peso corporal, mas também através de efeitos negativos sobre o sistema endócrino e imunológico. Mais da metade do efeito da dieta é devido a supernutrição (comer demais), ao invés da pouca ingestão de legumes ou outros alimentos saudáveis.[39]
Alguns alimentos específicos estão ligados a cânceres específicos. Uma dieta rica em sal está ligada ao câncer gástrico. A aflatoxina B1, que frequentemente contamina alimentos, provoca o câncer de fígado. A mastigação de noz de areca provoca câncer oral.[41] As diferenças de práticas alimentares podem explicar em parte as diferenças de incidência de câncer em diferentes países. Por exemplo, o câncer gástrico é mais comum no Japão, devido à dieta de alto teor salino da população local,[42] enquanto o câncer de cólon é mais comum nos Estados Unidos. Imigrantes também desenvolvem maior risco em seu novo país, muitas vezes dentro de uma geração, sugerindo um vínculo substancial entre dieta e câncer.[43]
Infecção
Em todo o mundo aproximadamente 18% das mortes por câncer estão relacionadas com doenças infecciosas.[6] Esta proporção varia em diferentes regiões do mundo de um máximo de 25% na África para menos de 10% no mundo desenvolvido.[6] Os vírus são agentes cancerígenos infecciosos usuais, mas bactérias e parasitas cancerosos também podem ter efeito.[6]
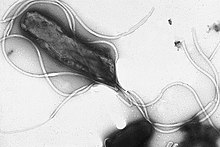
Os vírus que podem causar câncer são chamados de oncovírus. Estes incluem o papilomavírus humano (carcinoma cervical), o vírus de Epstein-Barr, o herpesvírus (sarcoma de Kaposi), a hepatite B e a hepatite C (carcinoma hepatocelular) e o vírus linfotrópico da célula T humana (leucemia de células T). A infecção bacteriana também pode aumentar o risco de câncer, como visto no carcinoma gástrico induzido por Helicobacter pylori.[44] Entre as infecções parasitárias fortemente associadas ao câncer estão a Schistosoma haematobium' (carcinoma de células escamosas da bexiga) e os vermes do fígado, como Opisthorchis viverrini e Clonorchis sinensis (colangiocarcinoma).[45]
Radiação
Até 10% dos cânceres invasivos estão relacionadas com a exposição à radiação, incluindo tanto a radiação ultravioleta quanto a radiação não ionizante.[6] Além disso, a grande maioria dos cânceres não invasivos são cânceres da pele que não são melanomas causados por radiação ultravioleta não ionizante, a maior parte proveniente da luz solar. Fontes de radiação ionizante incluem imagens médicas e gás radônio.[6]
A radiação ionizante não é um mutagênico particularmente forte.[46] A exposição residencial ao radônio, por exemplo, tem riscos de câncer semelhantes ao do tabagismo passivo.[46] A radiação é uma fonte mais potente de câncer quando é combinada com outros agentes causadores da doença, como a exposição a radônio, além de tabaco.[46] A radiação pode causar câncer na maioria das partes do corpo, em todos os animais e em qualquer idade. Crianças e adolescentes têm duas vezes mais probabilidade de desenvolver leucemia induzida por radiação que adultos; a exposição à radiação antes do nascimento tem dez vezes mais efeito.[46]
O uso médico da radiação ionizante é uma pequena, mas crescente, fonte de cânceres induzidos por radiação. A radiação ionizante pode ser utilizada para tratar outros tipos de cânceres, mas esta pode, em alguns casos, induzir a uma segunda forma da doença. Também é utilizada em alguns tipos de imagens médicas.[47]
A exposição prolongada à radiação ultravioleta do Sol pode conduzir a melanoma e outras malignidades de pele. Evidências estabelecem a radiação ultravioleta, em particular a onda média não ionizante UV, como a causa da maior parte dos cânceres da pele não melanoma, que são as mais formas comuns de câncer no mundo.[48]
A radiofrequência não ionizante a partir de celulares, transmissão de energia elétrica e de outras fontes semelhantes tem sido descrita como um possível agente cancerígeno pela Agência Internacional de Pesquisa em Câncer da Organização Mundial da Saúde.[49] No entanto, estudos não encontraram uma ligação consistente entre a radiação do telefone celular e o aumento do risco de câncer.[50]
Hereditariedade
A grande maioria dos cânceres não são hereditários ("cânceres esporádicos"). Cânceres hereditários são causados principalmente por um defeito genético herdado. Menos do que 0,3% da população é portadora de uma mutação genética que tem um grande efeito no risco de câncer e esta causa menos do que 3-10% de todos os casos de câncer no mundo.[51] Por exemplo, certas mutações hereditárias nos genes BRCA1 e BRCA2 ampliam em 75% o risco de câncer da mama, câncer de ovário[51] e de câncer colorretal hereditário sem polipose (que está presente em cerca de 3% das pessoas com câncer colorretal).[52]
Agentes físicos
Algumas substâncias causam câncer, principalmente através de seus efeitos físicos, em vez de químicos, sobre as células. Um exemplo proeminente disto é a prolongada exposição ao amianto, um composto que ocorre naturalmente em fibras minerais. Ele é uma das principais causas de mesotelioma, um câncer da membrana serosa que envolve os pulmões. Outras substâncias nesta categoria são wollastonita, paligorsquite, lã de vidro e lã mineral, que têm efeitos semelhantes. Materiais particulados não fibrosos que causam câncer incluem o pó metálico de cobalto e níquel e o dióxido de silício (quartzo, cristobalita e tridimita). Normalmente, agentes cancerígenos físicos devem ficar no interior do corpo (tal como por meio de inalação de pedaços minúsculos) e requerem anos de exposição para desenvolver câncer.[53]
É relativamente raro que traumas físicos resultem em câncer. Alegações de que ossos quebrados acabam por facilitar o desenvolvimento de câncer ósseo, por exemplo, nunca foram provadas. Da mesma forma, traumas físicos não são aceitos como uma das causas para o câncer de colo do útero, de mama ou no cérebro. Um mecanismo aceito é o contato frequente, a longo prazo, de objetos quentes com o corpo. É possível que repetidas queimaduras na mesma parte do corpo possam produzir câncer de pele, especialmente se substâncias químicas cancerígenas também estiverem presentes. Beber chá muito quente pode produzir câncer do esôfago. De um modo geral, acredita-se que o câncer surge através de um câncer preexistente que é estimulado durante o processo de reparação do trauma, ao invés de o câncer ser causado diretamente pelo trauma. No entanto, repetidas lesões nos mesmos tecidos podem promover uma proliferação celular excessiva, o que poderia, então, aumentar as chances de uma mutação cancerosa.[54]
É controverso se inflamações crônicas podem causar mutações diretamente.[54][55] Reconhece-se, no entanto, que a inflamação pode contribuir para a proliferação, a sobrevivência, a angiogênese e a migração de células cancerosas por influenciar o microambiente em torno dos tumores.[56][57] Além disso, os oncogenes são conhecidos por surgirem em um microambiente inflamatório pró-tumorigênico.[58]
Hormônios
Alguns hormônios desempenham um papel importante no desenvolvimento de câncer através da promoção da proliferação de células.[59] Os fatores de crescimento semelhante à insulina e as suas proteínas de ligação desempenham um papel fundamental na proliferação, diferenciação e apoptose de células cancerosas,, sugerindo um possível envolvimento na carcinogênese.[60]
Hormônios são agentes importantes em cânceres relacionados ao sexo, como o câncer de mama, do endométrio, da próstata, do ovário e do testículo, além do câncer de tireoide e ósseo. Por exemplo, as filhas de mulheres que têm câncer de mama têm níveis significativamente mais elevados de estrogênio e progesterona do que as filhas de mulheres sem câncer da mama. Estes níveis hormonais elevados podem explicar por que essas mulheres têm maior risco de desenvolver câncer de mama, mesmo na ausência de um gene deste tipo de câncer. Da mesma forma, os homens de ascendência africana têm níveis significativamente mais elevados de testosterona do que os homens de ascendência europeia, além de ter um nível correspondentemente muito maior de câncer de próstata, enquanto que homens de ascendência asiática têm níveis mais baixos de câncer de próstata.[59]
Outros fatores que também são relevantes: pessoas obesas têm níveis mais elevados de alguns hormônios associados ao câncer e uma taxa mais elevada de certos cânceres. As mulheres que fazem terapia de reposição hormonal têm um maior risco de desenvolver cânceres associados a esses hormônios. Por outro lado, pessoas que se exercitam muito mais do que a média têm menores níveis desses hormônios e menor risco de desenvolver câncer. O osteossarcoma pode ser promovido por hormônios de crescimento.[59]
Teratocarcinoma (teratomas malignos)
Teratomas são crescimentos descontrolados de células, que geralmente são compostos de vários tecidos, como cabelos, músculos e ossos, ocorrendo com maior frequência nos ovários (mulheres) e nos testículos (homens). Quando esses teratomas são malignos, eles são chamados de teratocarcinomas, sendo considerados um tipo de câncer.[61]
Nesse tipo de câncer, o tumor não é causado por uma mutação genética, mas sim pelo ambiente externo da célula. Através de experimentos, sendo o mais famoso realizado com camundongos, observou-se que se uma massa de células é colocada no interior de um blastocisto de camundongo, ela vai se integrar ao blastocisto, perder sua malignidade e se dividir normalmente; caso contrário, se ela for colocada em uma outra região, isso pode levar à formação do teratocarcinoma, tornando-se um tumor maligno.[61]
Defeitos na comunicação célula-célula
Alguns tipos de tumores podem ocorrer devido a uma deficiência na comunicação entre células. Essa comunicação é responsável por evitar a divisão celular descontrolada que pode dar origem ao tumor. Alguns estudos mostraram que tumores podem ser causados por alteração na estrutura de um tecido e que esses tumores podem ser suprimidos restaurando o ambiente do tecido apropriado.[61]
Esse defeito na comunicação celular pode causar metástases, pois assim como as células embrionárias, as células tumorais não costumam ficar paradas, elas migram e formam colônias, podendo se espalhar por todo o corpo. Uma das proteínas que tem um importante papel na comunicação célula-célula é a caderina, pois ela é responsável pela correta separação das células para formar os tecidos durante a divisão celular, em que as células formam fronteiras e se segregam dentro dos tecidos por meio da alteração de suas forças de ligação. Quando ocorre metástase, essa propriedade se perde, os níveis de caderina ficam abaixo do normal e a força de ligação à matriz extracelular e a outros tipos de células se torna maior do que as forças de coesão que mantêm o tecido junto. Como resultado, as células se tornam capazes de se espalhar para outros tecidos.[61]
O câncer colorretal é um exemplo em que o tumor é formado pelo defeito na comunicação célula-célula. Sabe-se que a adesão célula-célula desempenha um importante papel na manutenção da homeostase do tecido epitelial; uma desorganização dessa adesão influencia no desenvolvimento da carcinogênese, nesse caso no epitélio do reto. Essa adesão, como dito anteriormente, é favorecida pela caderina; no caso do epitélio retal, é a E-caderina quem exerce esse papel. Durante o processo de formação do câncer é observada uma expressão diminuída da E-caderina ou sua translocação da membrana plasmática para o citoplasma, causando uma desorganização da adesão célula-célula. Essa desorganização da adesão célula-célula pode ser mediada por diversos fatores, como por exemplo a endocitose de E-caderina ou a clivagem do domínio extracelular da E-caderina, resultando na E-caderina solúvel e na liberação do domínio intracelular para o citoplasma. Essa redução na expressão de E-caderina vai indicar um aumento na invasividade tumoral, sendo um tumor mais maligno, e também está correlacionada a um aumento na probabilidade de metástases e na mortalidade do paciente. Também foi descoberta uma relação entre as vias de sinalização celular envolvendo proteínas quinases (PKA) e GTPases, que são responsáveis por regular a organização do citoesqueleto de actina e das junções intercelulares, onde a E-caderina cumpre seu papel.[62]
Defeitos nas vias parácrinas
Em outros casos, pode ocorrer um defeito nas vias parácrinas. Nesses casos, células tumorais vão reativar vias parácrinas que são usadas durante o desenvolvimento. Sabe-se, por exemplo, que muitos tumores secretam o fator parácrino Sonic hedgehog (Shh). Shh não age nas células tumorais, mas nas células estromais, fazendo com que elas produzam fatores que suportam as células tumorais. Se a via do Shh é bloqueada, o tumor regride. Se isso não ocorrer, o tumor vai progredir.[61]
Foram descobertos três modelos básicos para explicar o envolvimento da via do Shh na formação de tumores. O primeiro tipo consiste em tumores que contêm mutações nas vias de ativação do Shh e que são independentes da ligação de Shh. O segundo tipo é autócrino e dependente da ligação ao Shh, o que significa que tanto a produção quanto a resposta de Shh são realizadas pelas mesmas células tumorais. Por fim, no terceiro tipo, os tumores são parácrinos e dependentes da ligação ao Shh, nesse caso o Shh produzido pelas células tumorais é recebido pelo estroma, que vai ativar outras vias de sinalização de volta ao tumor, promovendo seu crescimento.[63]
Diagnóstico
A maioria dos cânceres são inicialmente reconhecidos por causa de seus sintomas e sinais ou através de exames. Nenhum dos dois leva a um diagnóstico definitivo, que geralmente requer a opinião de um patologista. Pessoas com suspeita de câncer são investigadas com exames médicos. Estes geralmente incluem exames de sangue, radiografia, tomografia computadorizada, endoscopia, entre outros.[64]
Definição
Os cânceres são uma grande família de doenças que envolvem o crescimento celular anormal, com potencial para invadir e se espalhar para outras partes do corpo.[1][2] Eles formam um subconjunto de neoplasias. A neoplasia ou tumor é um grupo de células que foi submetido a um crescimento não regulado e, muitas vezes, forma uma massa, mas pode ser distribuído de forma difusa.[65][66]
Todas as células tumorais mostram as seis características de câncer. Estas são características que as células cancerosas precisam ter para produzir um tumor maligno. Elas incluem:[67]
- Crescimento e divisão celular sem os sinais adequados para o fazer;
- Crescimento contínuo da divisão celular mesmo quando existem sinais dizendo-lhes para parar;
- Anulação da morte celular programada;
- Número ilimitado de divisões celulares;
- Promoção da construção de vasos sanguíneos;
- Invasão de tecido e formação de metástases.[68]
A progressão das células normais para células que podem formar uma massa detectável até o surgimento do câncer definitivo é um processo que envolve vários passos conhecidos como "progressão maligna".[68][69]
Cânceres adultos
Nos Estados Unidos e em outros países desenvolvidos, o câncer é responsável por cerca de 25% de todas as mortes.[70] Anualmente, 0,5% da população é diagnosticada com câncer. As estatísticas abaixo são para adultos nos Estados Unidos e variam consideravelmente em outros países:
| Homens | Mulheres | |||
|---|---|---|---|---|
| mais comum | causa de morte[70] | mais comum | causa de morte[70] | |
| câncer de próstata (33%) | câncer de próstata (10%) | câncer de mama (32%) | câncer de mama (15%) | |
| câncer de pulmão (13%) | câncer de pulmão (31%) | câncer de pulmão (27%) | câncer de pulmão (12%) | |
| câncer colorretal (10%) | câncer colorretal (10%) | câncer colorretal (11%) | câncer colorretal (10%) | |
| câncer de bexiga (7%) | câncer pancreático (5%) | câncer endometrial (6%) | câncer ovariano (6%) | |
| melanoma cutâneo (5%) | leucemia (4%) | linfoma não Hodgkin (4%) | câncer pancreático (6%) | |
Cânceres infantis
O câncer também ocorre em crianças jovens e adolescentes, mas é raro. Alguns estudos concluíram que cânceres pediátricos, especialmente leucemia, estão em uma tendência de aumento de incidência.[71][72]
A idade do pico de incidência de câncer em crianças ocorre durante o primeiro ano de vida. Leucemia (geralmente leucemia linfoblástica aguda) é a forma maligna infantil mais comum (trinta por cento), seguida pelos do sistema nervoso central e neuroblastoma. Também são presentes o tumor de Wilms, linfomas, retinoblastoma, osteossarcoma e sarcoma de Ewing.[70]
Biópsia
A suspeita de câncer pode ocorrer por razões diversas, mas o diagnóstico definitivo da maioria dos casos malignos deve ser confirmado através de exame histológico das células cancerosas por um patologista. O tecido pode ser obtido através de uma biópsia ou cirurgia. Muitas biópsias (como aquelas da pele, mama ou fígado) podem ser feitas em um consultório médico. Biópsias em outros órgãos são realizadas sob anestesia e requerem cirurgia em uma sala de operação. O diagnóstico do tecido indica o tipo de célula que está proliferando, sua graduação histológica e outras características do tumor. Toda esta informação reunida é útil para avaliar o prognóstico do paciente e escolher o melhor tratamento. A citogenética e a imuno-histoquímica podem fornecer informações sobre o comportamento futuro do câncer (prognóstico) e melhor tratamento.[73]
Fisiopatologia
Genética
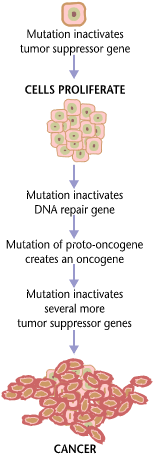
O câncer é fundamentalmente uma doença causada pela falha da regulação do crescimento de tecidos. Para que uma célula normal se transforme em uma célula cancerígena, os genes que regulam o crescimento e a diferenciação celular têm de ser alterados.[74]
Os genes afetados são divididos em duas grandes categorias. Oncogenes são os genes que promovem a reprodução e o crescimento celular. Genes supressores de tumores são genes que inibem a divisão celular. A transformação maligna pode ocorrer através da formação de novos oncogenes, da sobre-expressão inadequada de oncogenes normais, ou pela sub-expressão ou desativação de genes supressores de tumores. Normalmente, alterações em vários genes são necessárias para transformar uma célula normal em uma célula cancerosa.[75]
Alguns ambientes tornam mais susceptíveis o surgimento e a propagação dos erros genéticos. Tais ambientes podem incluir a presença de substâncias perturbadoras chamadas agentes cancerígenos, danos físicos repetidos, calor, radiações ionizantes ou hipoxia.[76]
A transformação de células normais em câncer é semelhante a uma reação em cadeia causada por erros iniciais, que criam erros progressivamente mais graves, permitindo que a célula escape dos controles que limitam o crescimento do tecido normal. Este cenário de "rebelião" torna-se uma indesejável sobrevivência do mais apto, onde as forças motrizes da evolução trabalham contra a concepção e a execução das ordens do corpo. Depois que o câncer começa a se desenvolver, este processo em curso, denominado "evolução clonal", impulsiona a progressão para estágios mais invasivos. A evolução clonal conduz à heterogeneidade intra-tumor, que complica o desenho de estratégias de tratamento eficazes.[77]
As características desenvolvidas por cânceres são divididas em várias categorias. Seis categorias foram originalmente propostas em um artigo de 2000 chamado The Hallmarks of Cancer, de Douglas Hanahan e Robert Allan Weinberg: evasão de apoptose; a autossuficiência em sinais de crescimento; insensibilidade aos sinais anti-crescimento; sustentada angiogênese; potencial replicativo ilimitado; e metástase. Com base em trabalhos futuros, os mesmos autores acrescentaram mais duas categorias em 2011: a reprogramação do metabolismo energético e a evasão de destruição imune.[68][69]
Epigenética
Classicamente, o câncer foi visto como um conjunto de doenças que são movidas por anormalidades genéticas progressivas que incluem mutações nos genes e oncogenes supressores de tumores e anormalidades cromossômicas. No entanto, tornou-se evidente que o câncer também é acionado por alterações epigenéticas.[78]
Alterações epigenéticas referem-se a modificações funcionalmente relevantes do genoma que não envolvem uma alteração na sequência de nucleótidos. Exemplos de tais modificações estão em alterações na metilação do DNA (hipermetilação e hipometilação), modificação da histona[79] e mudanças na arquitetura cromossômica (causadas pela expressão inapropriada de proteínas, tais como HMGA2 ou HMGA1). Cada uma destas alterações epigenéticas servem para regular a expressão do gene, sem alterar a sequência de DNA subjacente. Estas alterações podem permanecer através de divisões celulares, passadas por várias gerações e podem ser consideradas epimutações (equivalentes a mutações).[80]
Enquanto um grande número de alterações epigenéticas são encontradas em vários tipos de câncer, mudanças em genes de reparo causam a redução da expressão de proteínas de reparo do DNA, o que pode ser particularmente importante. Tais alterações podem ocorrer no início da progressão para o câncer e são uma causa provável da característica instabilidade genética de cânceres.[81][82][83][84]
Deficiências da expressão das proteínas de reparação de DNA, devido a uma mutação herdada, podem causar um maior risco de desenvolvimento de câncer. Os indivíduos com uma deficiência hereditária em qualquer um dos 34 genes de reparo de DNA têm um maior risco de câncer, sendo que alguns defeitos podem causar uma chance de até 100% de desenvolver câncer (mutações em p53, por exemplo).[85]
Cânceres surgem normalmente a partir de um conjunto de mutações e epimutações que conferem uma vantagem seletiva, levando a uma expansão clonal (ver Neoplasma). Mutações, no entanto, podem não ser tão frequentes em cânceres como as alterações epigenéticas. Um câncer de mama ou cólon comum pode ter cerca de 60 a 70 mutações que alteram a proteína, das quais cerca de três ou quatro podem ser mutações "definitivas", enquanto que os demais podem ser mutações "passageiras".[86]
Metástase
A metástase é a propagação do câncer para outros locais do corpo. Os novos tumores são chamados de tumores metastáticos, enquanto a massa original é chamada de tumor primário. Quase todos os tipos de câncer podem ter metástase.[87] A maioria das mortes por câncer ocorrem devido a propagação do câncer, a partir do seu local inicial, para outros órgãos.[88]
A metástase é muito comum nos últimos estágios do câncer e pode ocorrer através do sistema circulatório, do sistema linfático, ou de ambos. Os passos típicos da metástase são a invasão local, o intravasamento para o sangue ou a linfa, a circulação através do corpo, o extravasamento para o novo tecido, a proliferação e a angiogênese. Diferentes tipos de cânceres tendem a ter metástase para órgãos específicos, mas no geral os lugares mais comuns para metástases ocorrerem são pulmões, fígado, cérebro e ossos.[87]
Tratamento
Existem muitas opções de tratamento para o câncer, como cirurgia, quimioterapia, radioterapia, terapia hormonal, terapia-alvo e cuidados paliativos. A escolha dos tratamentos que serão utilizados depende do tipo, localização e estágio do câncer, bem como da saúde e dos desejos do paciente. O objetivo do tratamento pode ser curativo ou não curativo.
Quimioterapia
A quimioterapia é o tratamento do câncer com uma ou mais drogas anti-neoplásicas citotóxicas (agentes quimioterápicos), como parte de um regime normalizado. O termo engloba uma grande variedade de diferentes fármacos anticancerígenos, que são divididos em categorias amplas, tais como agentes alquilantes e anti-metabólitos. Os agentes quimioterápicos tradicionais atuam matando as células que se dividem muito rapidamente, uma das principais propriedades da maioria das células cancerosas.[89]
A terapia-alvo é uma forma de quimioterapia que tem como alvo as diferenças moleculares específicas entre o câncer e as células normais. As terapias direcionadas bloqueiam a molécula de receptor de estrogênio, o que inibe o crescimento de câncer de mama, por exemplo. Outro exemplo comum é a classe de inibidores de Bcr-Abl, que são utilizados para o tratamento de leucemia mielóide crônica (LMC).[90] Atualmente, não são orientados para câncer de mama, mieloma múltiplo, linfoma, câncer de próstata, melanoma e outros tipos de cânceres.[91]
A eficácia da quimioterapia tem sido amplamente questionada [92][93]. Em 2004, avaliaram 22 tipos de câncer e foi publicado que tratamentos quimioterápicos eram 97,9% ineficientes nos EUA e 97,7% na Austrália, dando como resultados que "a contribuição geral da quimioterapia citotóxica curativa e adjuvante para a sobrevida em 5 anos em adultos foi estimada em 2,3% na Austrália e 2,1% nos EUA"[94] o que adverte que "a quimioterapia citotóxica só faz uma pequena contribuição para a sobrevivência ao câncer" (ibdem). Recomendando aos departamentos de saúde de cada país que façam melhores estudos para "justificar o financiamento contínuo e a disponibilidade de medicamentos usados na quimioterapia citotóxica" (ibdem), o que exige "uma avaliação rigorosa do custo-benefício e do impacto na qualidade de vida é uma necessidade urgente" (ibdem).
Alguns autores concluem que a eficiência da quimioterapia vai depender do tipo e do estágio do câncer. Em combinação com a cirurgia, a quimioterapia tem se revelado útil em diferentes tipos de câncer, como da mama, colorretal, do pâncreas, osteossarcoma, testicular, do ovário e em certos tipos de câncer de pulmão.[95] A eficácia global varia entre a cura de alguns tipos de câncer, como algumas leucemias,[96][97] e a ineficácia completa, como em alguns tumores cerebrais,[98] ou ainda pode ser simplesmente desnecessária em outros, como na maioria dos cânceres de pele que não são melanomas.[99]
Radioterapia
A radioterapia envolve o uso de radiação ionizante para tentar curar ou melhorar os sintomas da doença. Ela funciona ao danificar o DNA do tecido canceroso, o que conduz à morte celular. Para poupar tecidos normais (tais como pele ou órgãos pelos quais a radiação precisa passar para tratar o tumor), feixes de radiação são lançados a partir de vários ângulos de exposição e se cruzam no tumor, proporcionando uma dose absorvida muito maior na massa cancerosa do que no tecido saudável do entorno. Tal como acontece com a quimioterapia, cânceres diferentes respondem de maneiras diferentes à terapia de radiação.[100][101][102]
A radioterapia é usada em cerca de metade de todos os casos e a radiação pode ser tanto de fontes internas, na forma de braquiterapia, ou de fontes de radiação externa. A radiação de raios-x é geralmente de baixa energia para o tratamento de cânceres da pele, enquanto que feixes de raios-x com graus mais elevados de energia são usados no tratamento de cânceres que se desenvolveram dentro do corpo.[103] A radiação é tipicamente utilizada em associação com cirurgias e/ou quimioterapia, mas para certos tipos de câncer, tais como na cabeça e no pescoço, pode ser utilizada isoladamente.[104] Para casos de metástases ósseas dolorosas, a radioterapia provou-se eficaz para cerca de 70% dos pacientes.[104]
Cirurgia
A cirurgia é o principal método de tratamento de cânceres sólidos mais isolados e pode desempenhar um papel relevante no tratamento paliativo e no prolongamento da sobrevivência do paciente. É tipicamente uma parte importante do diagnóstico definitivo e do estadiamento do tumor, visto que biópsias são geralmente necessárias. A cirurgia de câncer localizado normalmente tenta remover toda a massa, em certos casos, juntamente com os nódulos linfáticos na área. Para alguns tipos de câncer a cirurgia elimina a doença por completo.[95]
Cuidados paliativos
Os cuidados paliativos se referem ao tratamento que tenta fazer com que o paciente se sinta melhor e podem ou não pode ser combinados com uma tentativa de tratar o câncer. Os cuidados paliativos incluem medidas para reduzir o sofrimento físico, emocional, espiritual e psicossocial vivido por pessoas com câncer. Ao contrário do tratamento que visa matar diretamente as células cancerosas, o principal objetivo dos cuidados paliativos é melhorar a qualidade de vida da pessoa. Pessoas em todas as fases do tratamento de câncer devem ter algum tipo de cuidado paliativo para proporcionar conforto. Em alguns casos, as organizações profissionais de especialidades médicas recomendam que as pessoas e os médicos respondam ao câncer apenas com cuidados paliativos e não com a terapia dirigida a cura.[105]
Os cuidados paliativos são muitas vezes confundidos com a chamada "unidade de cuidados paliativos", que é aplicada em pacientes terminais. Os cuidados paliativos na verdade tentam ajudar a pessoa a lidar com as necessidades imediatas e aumentar o seu conforto. Várias organizações médicas recomendam cuidados paliativos logo no início do diagnóstico para pessoas cujo câncer produz sintomas angustiantes (como dor, falta de ar, fadiga e náuseas) ou que precisam de ajuda para lidar com a sua doença. Em pessoas que têm a doença metastática quando diagnosticadas pela primeira vez, os oncologistas devem considerar iniciar os cuidados paliativos imediatamente. Além disso, um oncologista deve considerar um tratamento paliativo em qualquer pessoa que tiver uma estimativa de menos de 12 meses de vida, mesmo se continuar com o tratamento agressivo.[106][107][108]
Imunoterapia
Várias terapias que utilizam a imunoterapia, que são estimulantes que ajudam o sistema imunológico a combater o câncer através do uso de substâncias modificadoras da resposta biológica, entraram em uso a partir de 1997 e continuam a ser uma área de pesquisa muito ativa.[109] Muitos estudos clínicos ligados a ação anti-câncer usando linfócitos T foram aprovados já na fase tardia.[110]
A imunoterapia pode ser classificada em "ativa" e "passiva", de acordo com as substâncias utilizadas. Na imunoterapia ativa, substâncias estimulantes e restauradores das defesas do corpo são administradas com a finalidade de intensificar a resistência do organismo ao crescimento do tumor. Na imunoterapia passiva, anticorpos antitumorais são administrados para proporcionar uma maior capacidade imunológica de combate ao câncer. No entanto, a imunoterapia ainda é uma alternativa experimental, sendo que resultados mais conclusivos sobre sua eficácia e aplicabilidade clínica devem ser obtidos antes do seu uso em larga escala.[111]
Medicina alternativa
Tratamentos complementares e alternativos para o câncer são um grupo diverso de sistemas, práticas e produtos de assistência médica que não fazem parte da medicina convencional.[112] A "medicina complementar" refere-se a métodos e substâncias utilizadas juntamente com a medicina convencional, enquanto que a "medicina alternativa" refere-se a compostos utilizados em substituição de métodos convencionais.[113] Medicamentos complementares e alternativos para o câncer não foram rigorosamente estudados ou testados, em geral, na fase clínica (humanos), devido principalmente esta fase representar altos gastos médios, muitos discutem os valores anunciados médios de US$ 802 milhões[114] e outros ainda aumentam este valor. De toda forma este sistema convalidatório tem acabado por privilegiar quase apenas fórmulas que tenham exclusividade de fabricação, o que daria aos investidores a garantia de retorno do capital investido e lucro. Por esta razão muitos medicamentos de compostos naturais, fórmulas conhecidas e associações a patentes vencidas, ficam marginalizados, bem como sistemas de tratamento que não represente ganhos compatíveis aos gastos da pesquisa clínica. Alguns tratamentos alternativos têm sido investigados e mostraram-se eficazes e outros ineficazes, e continuam a ser comercializados e promovidos.[115]
Muitos centros de pesquisa tem promovido dietas e mudança de estilo de vida como tendo eficiência anti-câncer com resultados publicados de regressão de câncer em humanos[116][117] [118] e uma infinidade de estudos pré-clínicos confirmam de forma inversa, as práticas milenares medicinais em humanos, no uso de alimentos e plantas anticancerígenas.[119] [120][121][122]
Terapia de diferenciação
Foi observado que as células cancerosas eram de muitas maneiras reversões para células embrionárias, sendo assim foi hipotetizado que células cancerígenas deveriam reverter para a normalidade se elas fossem estimuladas a se diferenciarem.[61]
No trabalho realizado por Sachs descobriu-se que certas leucemias podiam ser controladas fazendo com que suas células se diferenciassem e não se proliferassem. Uma dessas leucemias, APL, é causada por uma recombinação somática criando um novo fator de transcrição, cujas partes é um receptor de ácido retinoico. A expressão desse fator de transcrição em progenitores neutrófilos faz com que a célula se torne maligna. O tratamento de pacientes com APL usando ácido retinoico trans causa a remissão do APL em mais de 90% dos casos, desde que o ácido retinoico adicional seja capaz de afetar a diferenciação das células leucêmicas em neutrófilos normais.[123]
Prognóstico
O câncer tem uma reputação de ser uma doença mortal. Como um todo, cerca de metade das pessoas que recebem tratamento para câncer invasivo (excluindo o carcinomas e câncer de pele não melanoma) morrem em decorrência da doença ou do tratamento.[23] A sobrevivência é pior no mundo em desenvolvimento,[23] em parte porque os tipos de cânceres mais comuns nessas regiões são mais difíceis de tratar do que aqueles associados com o estilo de vida de países desenvolvidos.[124] No entanto, as taxas de sobrevivência variam dramaticamente de acordo com o tipo de câncer e com o estágio de desenvolvimento da doença no momento em que ela é diagnosticada. Após o câncer ter metástase ou se propagar para além do seu local original, o prognóstico normalmente torna-se muito pior.[125]
Aqueles que sobrevivem a um câncer têm cerca de duas vezes mais risco de desenvolver um segundo câncer primário em relação à taxa registrada naqueles que nunca foram diagnosticados com a doença.[126] Acredita-se que o aumento do risco deve-se, principalmente, aos mesmos fatores de risco que produziram o primeiro câncer, em parte por conta do tratamento oferecido e a um melhor cumprimento de triagem.[126]
Prever a sobrevivência de curto e longo prazo é difícil e depende de muitos fatores. Os fatores mais importantes são o tipo específico de câncer e a idade e a saúde geral do paciente. As pessoas que são frágeis, com muitos outros problemas de saúde, têm taxas de sobrevivência mais baixas do que as pessoas saudáveis. É improvável que centenários sobrevivam por mais de cinco anos após o diagnóstico, mesmo se o tratamento for bem sucedido. As pessoas que relatam uma maior qualidade de vida tendem a sobreviver mais tempo. As pessoas com baixa qualidade de vida podem ser afetadas por um transtorno depressivo maior e por outras complicações do tratamento contra o câncer e/ou a progressão da doença. Além disso, os pacientes com pior prognóstico podem relatar uma menor qualidade de vida, porque eles percebem corretamente que a sua condição médica pode ser fatal.[127]
Pessoas com câncer, mesmo aquelas que caminham por conta própria, têm um risco aumentado de coágulos sanguíneos nas veias. A utilização de heparina parece melhorar a sobrevivência e diminuir o risco de formação de coágulos sanguíneos.[128]
Prevenção
A prevenção é definida como uma série de medidas ativas que podem diminuir o risco de desenvolvimento de câncer.[129] A grande maioria dos casos de câncer ocorrem devido a fatores de risco ambientais e muitos, se não todos, são escolhas de estilo de vida controláveis. Assim, o câncer é considerado uma doença em grande parte evitável.[130] Entre 70% e 90% dos cânceres comuns são devidos a fatores ambientais e, portanto, possivelmente evitáveis.[131]
Mais de 30% das mortes por câncer poderia ser prevenida evitando-se fatores de risco, como tabagismo, excesso de peso/obesidade, dieta insuficiente, sedentarismo, alcoolismo, doenças sexualmente transmissíveis e poluição do ar. No entanto, nem todas as causas ambientais são controláveis, tais como a ocorrência natural de radiação. Ademais, alguns tipos de câncer são causados por doenças genéticas hereditárias e, assim, não é possível evitar todos os casos da doença.[132]
Alimentação
Enquanto muitas recomendações dietéticas têm sido propostas para reduzir o risco de câncer, a evidência para apoiá-las não é definitiva.[12][133] Os fatores dietéticos primários que aumentam o risco são a obesidade e o consumo de álcool; uma dieta pobre em frutas e legumes e rica em carne vermelha também foi apontada, mas não confirmada.[134][135] Um estudo de 2014 não encontrou uma relação entre consumo de frutas e vegetais e o câncer.[136] O consumo de café está associado a um risco reduzido de câncer de fígado.[137] Estudos têm relacionado o consumo excessivo de carne vermelha ou processada com o aumento do risco de câncer de mama, câncer de cólon e câncer de pâncreas, um fenômeno que poderia ocorrer devido à presença de substâncias cancerígenas em carnes cozidas em altas temperaturas.[138][139] Isto foi confirmado em 2015 pela Agência Internacional de Pesquisa em Câncer, da Organização Mundial da Saúde (OMS), que determinou que a ingestão de carne processada (por exemplo, bacon, presunto, cachorros-quentes, salsichas) e, em menor grau, carne vermelha, foi associada a alguns tipos de câncer.[140][141]
Recomendações dietéticas para a prevenção do câncer geralmente incluem uma maior ênfase em legumes, frutas, grãos integrais e peixes, além de se evitar o consumo de carne processada e vermelha (carne de vaca, porco, cordeiro), gorduras animais e carboidratos refinados.[12][133]
Medicação
O conceito de que medicamentos podem ser utilizados para prevenir o câncer é atraente e evidências apoiam a sua utilização em algumas circunstâncias definidas.[142] Na população em geral, anti-inflamatórios não esteroides (AINEs) reduzem o risco de câncer colorretal, no entanto, devido aos efeitos secundários cardiovasculares e gastrointestinais, eles causam danos globais quando utilizados para a prevenção.[143] A aspirina também reduz o risco de morte por câncer em cerca de 7%.[144] Inibidores seletivos de COX-2 podem diminuir a taxa de formação de pólipos em pessoas com polipose adenomatosa familiar, no entanto estão associados com os mesmos efeitos adversos dos AINEs.[145] A utilização diária de tamoxifeno ou raloxifeno tem sido demonstrada como eficaz na redução do risco de desenvolver câncer da mama em mulheres com alto risco.[146] O benefício contra danos por inibidor da 5-alfarredutase, tal como finasterida, ainda não foi confirmado.[147]
As vitaminas não foram provadas como eficazes na prevenção de câncer,[148] embora os níveis sanguíneos de vitamina D estejam correlacionados com um risco aumentado do câncer.[149][150] A hipótese de que esta relação é causal e que suplementação com vitamina D causa algum grau de proteção ainda não foi comprovada.[151] A suplementação com beta-caroteno aumenta as taxas de câncer de pulmão em pessoas com alto risco.[152] A suplementação com ácido fólico não previne o câncer de cólon e pode aumentar pólipos do cólon.[153] Não está claro se a suplementação com selênio tem algum efeito.[154]
Vacinação
Foram desenvolvidas vacinas que previnem a infecção por alguns vírus cancerígenos.[155] A vacina contra hepatite B (Gardasil e Cervarix) diminui o risco de desenvolvimento de câncer cervical.[155] A vacina contra o HPV previne a infecção pelo vírus da hepatite B e, consequentemente, diminui o risco de câncer de fígado.[155] A administração de vacinas de papilomavírus humano e da hepatite B é recomendada quando tais recursos estão disponíveis.[156]
Rastreio
Ao contrário de um diagnóstico motivado por sinais e sintomas médicos, o rastreio do câncer envolve esforços para encontrar a doença depois de ter sido formada, mas antes de apresentar quaisquer sintomas perceptíveis. O rastreio pode envolver exames físicos, de sangue, de urina, ou imagiologia médica.[157]
O rastreio do câncer não está atualmente disponível para muitos tipos da doença e, mesmo quando tais testes estão disponíveis, eles podem não ser recomendados para todos os pacientes. A triagem universal ou o rastreio em massa envolve o rastreio de toda uma população,[158] enquanto a triagem prescritiva analisa apenas os pacientes que conhecidamente têm maior risco de desenvolver a doença, tais como pessoas com histórico familiar de casos de câncer.[158] Vários fatores são considerados para determinar se os benefícios do rastreio superam os riscos e os custos de triagem.[157]
Recomendações
O rastreio do câncer do colo do útero é recomendado em mulheres de até 65 anos de idade que sejam sexualmente ativas e que tenham cérvix.[159] O rastreio do câncer colorretal é indicado através de testes de sangue oculto nas fezes, sigmoidoscopia ou colonoscopia desde os 50 anos até os 75 anos de idade.[160] Não há evidências suficientes para recomendar ou desaconselhar o rastreamento dos cânceres de pele,[161] oral,[162] de pulmão,[163] ou de próstata em homens com menos de 75 anos de idade.[164]
A mamografia para detecção do câncer de mama é recomendada a cada dois anos para mulheres entre 50 e 74 anos de idade.[165] No entanto, uma análise de 2011 da Colaboração Cochrane chegou a conclusões ligeiramente diferentes em relação à triagem do câncer de mama, ao afirmar que a mamografia de rotina pode ser mais prejudicial do que benéfica.[166]
Testes genéticos
| Gene | Tipos de câncer |
|---|---|
| BRCA1, BRCA2 | Mama, ovário, pâncreas |
| HNPCC, MLH1, MSH2, MSH6, PMS1, PMS2 | Cólon, uterino, intestino delgado, estômago, trato urinário |
Testes genéticos são recomendados para pessoas com alto risco de desenvolver determinados tipos de câncer.[156][167] Portadores de tais mutações podem, em seguida aos exames genéticos, passarem a ser alvo de vigilância médica, de quimioprevenção ou de cirurgias preventivas para reduzir o risco de desenvolver a doença no futuro.[167]
Epidemiologia
Em 2008, cerca de 12,7 milhões de casos de câncer foram diagnosticados (excluindo câncer de pele não melanoma e outros cânceres não invasivos)[23] e em 2010 cerca de 7,98 milhões de pessoas morreram por causa da doença.[169] O câncer causa aproximadamente 13% de todas as mortes anuais, sendo os tipos mais comuns: câncer de pulmão (1,4 milhão de mortes); câncer do estômago (740 mil mortes); câncer de fígado (700 mil mortes); câncer colorretal (610 mil mortes); e câncer da mama (460 mil mortes).[170] Este câncer invasivo é a principal causa de morte no mundo desenvolvido e a segunda principal causa de morte no mundo em desenvolvimento.[23] Mais de metade dos casos ocorrem no mundo em desenvolvimento.[23]
Foram registradas 5,8 milhões de mortes por câncer em 1990[169] e as taxas têm aumentado, principalmente devido a uma população mais longeva e por mudanças no estilo de vida no mundo em desenvolvimento.[23] O fator de risco mais importante para o desenvolvimento de câncer é a velhice.[171] Embora seja possível que o câncer surja em qualquer idade, a maioria das pessoas que são diagnosticadas com câncer invasivo tem em torno de 65 anos de idade.[171] De acordo com o pesquisador Robert A. Weinberg: "Se vivêssemos tempo suficiente, mais cedo ou mais tarde todos nós teríamos câncer".[172] A associação entre o envelhecimento e o câncer é atribuída a imunossenescência,[173] erros acumulados no DNA ao longo da vida[174] e alterações relacionadas com a idade no sistema endócrino.[175] O efeito da envelhecimento sobre o câncer é complexo, com uma série de fatores, tais como danos no DNA.[176]
Alguns tipos de câncer de crescimento lento são particularmente comuns. Estudos de autópsias na Europa e na Ásia têm mostrado que até 36% das pessoas não foram diagnosticadas com câncer de tireoide, aparentemente inofensivo, no momento da sua morte e que 80% dos homens desenvolvem câncer de próstata aos 80 anos.[177][178]
Os três tipos de cânceres mais comuns na infância são leucemia (34%), tumores cerebrais (23%) e linfomas (12%).[179] Nos Estados Unidos o câncer afeta cerca de 1 em 285 crianças.[180] As taxas de câncer infantil aumentaram 0,6% por ano no período entre 1975 e 2002 nos Estados Unidos[181] e de 1,1% por ano entre 1978 e 1997 na Europa.[179] As mortes por câncer infantil diminuíram pela metade desde 1975 nos Estados Unidos.[180]
Em Portugal
Em 2016, morreram em Portugal 27.900 pessoas vítimas de cancro, mais 3% do que no ano anterior. O cancro do pulmão foi o que mais matou, seguido do carcinoma do cólon e do reto, o da mama e o da próstata.[182]
História
O câncer tem existido por toda a história da humanidade.[183] O mais antigo registro escrito sobre o câncer é de cerca de 1600 a.C., no Papiro de Edwin Smith do Egito Antigo e que descreve o câncer de mama.[183] Hipócrates (cerca de (460–370 a.C.)) descreveu vários tipos de câncer, referindo-se a eles com a palavra grega καρκίνος karkinos (caranguejo ou lagostas).[183] Este nome vem da aparência da superfície de corte de um tumor maligno sólido, com "as veias esticadas por todos os lados como o animal caranguejo tem seus pés, de onde deriva seu nome".[184] Cláudio Galeno afirmou que "o câncer da mama é assim chamado por causa da semelhança imaginária de um caranguejo, em vista dos prolongamentos laterais do tumor e as veias dilatadas adjacentes.".[185] Aulo Cornélio Celso (cerca de (25 a.C.–50 d.C.)) traduziu karkinos para o latim cancer, que também significa caranguejo, e recomendou a cirurgia como tratamento.[183] Galeno (século II d.C.) discordava do uso de cirurgia e recomendava purgantes.[183] Estas recomendações em grande parte permaneceram por mil anos.[183]
Nos séculos XV, XVI e XVII, tornou-se aceitável que os médicos dissecassem corpos para descobrir a causa da morte.[186] O professor alemão Wilhelm Fabry acreditava que o câncer de mama era causado por um coágulo de leite em um duto mamário. O professor holandês Franciscus Sylvius, um seguidor de Descartes, acreditava que toda doença era o resultado de processos químicos e que o fluido linfático ácido era a causa do câncer. Seu contemporâneo Nicolaes Tulp acreditava que o câncer era um veneno que se espalhava lentamente e concluiu que era contagioso.[187]
O médico John Hill descreveu o rapé de tabaco como a causa de câncer de nariz em 1761.[186] Em 1775 o cirurgião britânico Percivall Pott escreveu um relatório onde dizia que um tipo específico de câncer no escroto era uma doença comum entre limpadores de chaminés.[188] Com o uso generalizado do microscópio, no século XVIII, foi descoberto que o "veneno câncer" se espalhava a partir do tumor primário através dos gânglios linfáticos para outros locais do corpo ("metástase"). Este ponto de vista da doença foi formulado pela primeira vez pelo cirurgião britânico Campbell De Morgan entre 1871 e 1874.[189]
Pesquisa
Como o câncer é uma classe de doenças,[190][191] é improvável que algum dia haverá uma "cura universal",[192] visto que não haverá um único tratamento para todos os diferentes tipos de cânceres. Inibidores da angiogênese, outrora pensados como um potencial tratamento eficaz e aplicável a muitos tipos de cânceres, não têm mostrado a eficácia esperada no tratamento.[193] É mais provável que os inibidores da angiogênese e outros terapêuticos para o câncer sejam utilizados em combinação com outros tratamentos complementares para reduzir a morbidade e a mortalidade da doença.[194]
Tratamentos experimentais para o câncer são terapias que estão sendo estudadas para testar sua eficácia. Tipicamente, tais terapias são estudadas em ensaios clínicos para comparar o tratamento proposto com o melhor tratamento existente. Eles podem ser tratamentos inteiramente novos ou tratamentos que têm sido usados com êxito em um determinado tipo de câncer e que agora estão sendo testados em outro tipo.[195] Novos tratamentos estão sendo desenvolvidos, assim como novos testes de diagnóstico, para direcionar os medicamentos certos para os pacientes certos, com base na biologia individual de cada pessoa.[196]
A melhor compreensão da biologia molecular e da biologia celular, devido à investigação do câncer, levou a uma série de novos tratamentos para a doença desde que o então Presidente dos Estados Unidos, Richard Nixon, declarou a "guerra contra o câncer", em 1971. Desde então, os Estados Unidos gastaram mais de 200 bilhões de dólares em pesquisas sobre a doença, incluindo recursos dos setores público e privado.[197] Durante esse período, o país viu uma redução de 5% na taxa de mortalidade do câncer (ajustado ao tamanho e idade da população) entre 1950 e 2005.[198]
A disputa pelos recursos financeiros que são necessários para conduzir experimentos científicos sobre o câncer tende a suprimir a criatividade, a cooperação e a assunção de riscos dos pesquisadores, justamente por favorecer pesquisas de baixo risco financeiro que focam em pequenos avanços incrementais, ao invés de pesquisas realmente inovadoras que possam descobrir terapias novas e radicalmente melhores para o tratamento da doença.[199][200] Outras consequências da alta competitividade por recursos é o número substancial de publicações científicas cujos resultados não podem ser replicados, além de incentivos perversos no financiamento da investigação que acabam por estimular as instituições beneficiárias a crescer sem fazer investimentos suficientes em seu próprio corpo docente e/ou em suas instalações físicas.[201][202]
Impacto
Sociocultural
Apesar de outras doenças (como a insuficiência cardíaca) poderem ter um prognóstico mais grave do que a maioria dos cânceres, esta é tema de medo generalizado e de tabus. O eufemismo "depois de uma longa batalha" ainda é comumente usado, refletindo um estigma em relação à doença.[203] Essa crença profunda de que o câncer é necessariamente uma doença difícil ou mortal se reflete nos sistemas escolhidos pela sociedade para compilar estatísticas: as formas mais comuns de câncer — o câncer de pele não melanoma representa cerca de um terço de todos os casos de câncer no mundo, mas com pouca evidência de mortes[204][205] — são excluídas das estatísticas de câncer especificamente porque são facilmente tratáveis e com alto índice de cura.[206]
O câncer é uma doença que deve ser "combatida" para acabar com a "rebelião" do corpo; metáforas militares (metáforas de guerra) são particularmente comuns nas descrição de sintomas e patologias do câncer, levando a estigmatização do paciente, enfatizando o estado precário de saúde do paciente em relação a tomar ações imediatas e decisivas sobre o ocorrido, ou seja, levando o paciente a fazer sacrifícios para eliminar a ameaça à vida, em vez de incentivar a confiança nos tratamentos ou no auxílio de outrem e desencadeando a atribuição de culpa ao paciente.[207][208] As metáforas militares também ajudam a racionalizar os tratamentos mais radicais e destrutivos.[209][210]
Na década de 1970, ocorreu um tratamento alternativo para um câncer relativamente popular através de psicoterapia especializada, com base na ideia de que o câncer era causado por uma má atitude. Dizia-se que pessoas com uma "personalidade cancerígena" (depressivas, reprimidas, com auto-aversão e com medo de expressar suas emoções) manifestavam o câncer através do desejo subconsciente. O tratamento baseava-se em alterar a perspectiva do paciente sobre a vida e assim curar o câncer.[211] Entre outros efeitos, esta crença permitia que a sociedade culpasse a vítima por ser "causadora" da doença ou ter "impedido" sua cura (por ser infeliz). Além disso, este método aumentava a ansiedade dos pacientes, pois eles acreditavam erroneamente que as emoções naturais de tristeza, raiva ou medo encurtavam a vida.[212] A ideia foi execrada pela escritora ativista Susan Sontag, que publicou o livro "Doença como Metáfora" (em inglês: Illness as Metaphor) enquanto se recuperava de um câncer da mama em 1978.[211] Embora esta ideia atualmente seja considerada absurda, ela persiste, em parte, como uma forma reduzida de uma crença generalizada, mas incorreta, de que, deliberadamente, cultivar o hábito do "pensamento positivo" irá aumentar a sobrevida das pessoas. Esta noção é particularmente forte na cultura do câncer de mama.[212]
Econômico
Em 2007, os custos globais de câncer nos Estados Unidos - incluindo o tratamento e as despesas da mortalidade indiretas (como a perda de produtividade no trabalho) - foram estimados em 226,8 bilhões de dólares. Em 2009, 32% dos hispânicos e 10% das crianças de até 17 anos não tinham plano de saúde; "minorias étnicas são substancialmente mais propensas a serem diagnosticadas com câncer em um estágio avançado, quando o tratamento pode ser mais extenso e mais caro.".[213]
A Europa gasta cerca de 100 bilhões de euros por ano com pacientes cancerígenos, de acordo com um estudo sobre o impacto econômico da doença na região - divulgado no Congresso da Sociedade Europeia de Oncologia Médica de 2012, realizado em Viena, na Áustria.[214]
A cada ano, o câncer absorve aproximadamente 2 trilhões de dólares da economia mundial, em termos de perda de produção e custos de tratamentos, o que equivale a cerca de 1,5% do produto interno bruto (PIB) global (dados de 2015).[18][215]
Outros animais
A oncologia veterinária, que concentra-se principalmente em cães e gatos, é uma especialidade crescente nos países desenvolvidos e pode oferecer aos animais as principais formas de tratamento dado a humanos, tais como cirurgias e radioterapia.[216]
Os tipos comuns de câncer diferem, mas a incidência da doença parece ser tão elevada em animais de estimação quanto em seres humanos. Animais, geralmente roedores, são frequentemente utilizados em pesquisas sobre câncer. Ademais, estudos de cânceres naturais registrados em animais de maior porte podem beneficiar na investigação do câncer humano.[216]
Em animais não humanos, foram detectados alguns tipos de cânceres transmissíveis, onde a doença se espalha entre os indivíduos através das próprias células tumorais. Este fenômeno é visto em cães com sarcoma de Sticker, também conhecido como tumor venéreo transmissível canino, bem como em tumores faciais em diabos-da-tasmânia.[217]
Ver também
Referências
- ↑ a b c d e f g h «Cancer Fact sheet N°297». World Health Organization. Fevereiro de 2014. Consultado em 10 de junho de 2014
- ↑ a b c d «Defining Cancer». National Cancer Institute. Consultado em 10 de junho de 2014
- ↑ a b «Cancer - Signs and symptoms». NHS Choices. Consultado em 10 de junho de 2014
- ↑ «Cigarro mata mais de 5 milhões de pessoas, segundo OMS». Governo Federal do Brasil. 29 de agosto de 2014. Consultado em 28 de março de 2016
- ↑ «Obesity and Cancer Risk». National Cancer Institute. 3 de janeiro de 2012. Consultado em 4 de julho de 2015
- ↑ a b c d e f g h i Anand P, Kunnumakkara AB, Kunnumakara AB, Sundaram C, Harikumar KB, Tharakan ST, Lai OS, Sung B, Aggarwal BB (setembro de 2008). «Cancer is a preventable disease that requires major lifestyle changes». Pharm. Res. 25(9): 2097–116. PMC 2515569
 . PMID 18626751. doi:10.1007/s11095-008-9661-9
. PMID 18626751. doi:10.1007/s11095-008-9661-9 - ↑ a b c d e f g World Cancer Report 2014. [S.l.]: World Health Organization. 2014. pp. Chapter 1.1. ISBN 9283204298
- ↑ «Heredity and Cancer». American Cancer Society. Consultado em 22 de julho de 2013
- ↑ «How is cancer diagnosed?». American Cancer Society. 29 de janeiro de 2013. Consultado em 10 de junho de 2014
- ↑ a b World Cancer Report 2014. [S.l.]: Organização Mundial da Saúde. 2014. pp. Chapter 4.7. ISBN 9283204298
- ↑ Gøtzsche PC, Jørgensen KJ (4 de junho de 2013). «Screening for breast cancer with mammography.». The Cochrane database of systematic reviews. 6: CD001877. PMID 23737396. doi:10.1002/14651858.CD001877.pub5
- ↑ a b c Kushi LH, Doyle C, McCullough M; et al. (2012). «American Cancer Society Guidelines on nutrition and physical activity for cancer prevention: reducing the risk of cancer with healthy food choices and physical activity». CA Cancer J Clin. 62 (1): 30–67. PMID 22237782. doi:10.3322/caac.20140
- ↑ Parkin, DM; Boyd, L; Walker, LC (6 de dezembro de 2011). «16. The fraction of cancer attributable to lifestyle and environmental factors in the UK in 2010.». British Journal of Cancer. 105 Suppl 2: S77-81. PMC 3252065
 . PMID 22158327. doi:10.1038/bjc.2011.489
. PMID 22158327. doi:10.1038/bjc.2011.489 - ↑ «Targeted Cancer Therapies». NCI. 25 de abril de 2014. Consultado em 11 de junho de 2014
- ↑ a b World Cancer Report 2014. [S.l.]: World Health Organization. 2014. pp. Chapter 1.3. ISBN 9283204298
- ↑ «SEER Stat Fact Sheets: All Cancer Sites». National Cancer Institute. Consultado em 18 de junho de 2014
- ↑ «The top 10 causes of death Fact sheet N°310». WHO. Maio de 2014. Consultado em 10 de junho de 2014
- ↑ a b O Globo, ed. (9 de julho de 2015). «O desafio do combate ao câncer». Consultado em 18 de março de 2016
- ↑ World Cancer Report 2014. [S.l.]: World Health Organization. 2014. pp. Chapter 6.7. ISBN 9283204298
- ↑ Dubas, LE; Ingraffea, A (fevereiro de 2013). «Nonmelanoma skin cancer.». Facial plastic surgery clinics of North America. 21(1): 43–53. PMID 23369588. doi:10.1016/j.fsc.2012.10.003
- ↑ Cakir, BÖ; Adamson, P; Cingi, C (novembro de 2012). «Epidemiology and economic burden of nonmelanoma skin cancer.». Facial plastic surgery clinics of North America. 20 (4): 419–22. PMID 23084294. doi:10.1016/j.fsc.2012.07.004
- ↑ «Tratamento do câncer fica mais caro no Brasil e no mundo». Agência INCA de Notícias. 27 de novembro de 2007. Consultado em 29 de março de 2015
- ↑ a b c d e f g Jemal A, Bray, F, Center, MM, Ferlay, J, Ward, E, Forman, D (fevereiro de 2011). «Global cancer statistics». CA: a cancer journal for clinicians. 61 (2): 69–90. PMID 21296855. doi:10.3322/caac.20107
- ↑ FERREIRA, A. B. H. Novo Dicionário da Língua Portuguesa. Segunda edição. Rio de Janeiro: Nova Fronteira, 1986. p.332
- ↑ FERREIRA, A. B. H. Novo Dicionário da Língua Portuguesa. Segunda edição. Rio de Janeiro: Nova Fronteira, 1986. p.333
- ↑ a b c d e Holland Chp. 1
- ↑ O'Dell, edited by Michael D. Stubblefield, Michael W. (2009). Cancer rehabilitation principles and practice. New York: Demos Medical. p. 983. ISBN 978-1-933864-33-4
- ↑ Kravchenko J, Akushevich I, Manton, KG (2009). Cancer mortality and morbidity patterns in the U. S. population: an interdisciplinary approach. Berlin: Springer. ISBN 0-387-78192-7
- ↑ Tolar J, Neglia JP (junho de 2003). «Transplacental and other routes of cancer transmission between individuals». J. Pediatr. Hematol. Oncol. 25 (6): 430–4. PMID 12794519. doi:10.1097/00043426-200306000-00002
- ↑ Biesalski HK, Bueno de Mesquita B, Chesson A, Chytil F, Grimble R, Hermus RJ, Köhrle J, Lotan R, Norpoth K, Pastorino U, Thurnham D (1998). «European Consensus Statement on Lung Cancer: risk factors and prevention. Lung Cancer Panel». CA Cancer J Clin. 48 (3): 167–76; discussion 164–6. PMID 9594919. doi:10.3322/canjclin.48.3.167
- ↑ Kuper H, Boffetta P, Adami HO (setembro de 2002). «Tobacco use and cancer causation: association by tumour type». Journal of Internal Medicine. 252 (3): 206–24. PMID 12270001. doi:10.1046/j.1365-2796.2002.01022.x
- ↑ a b Kuper H, Adami HO, Boffetta P (junho de 2002). «Tobacco use, cancer causation and public health impact». Journal of Internal Medicine. 251 (6): 455–66. PMID 12028500. doi:10.1046/j.1365-2796.2002.00993.x
- ↑ Sasco AJ, Secretan MB, Straif K (agosto de 2004). «Tobacco smoking and cancer: a brief review of recent epidemiological evidence». Lung Cancer. 45 Suppl 2: S3–9. PMID 15552776. doi:10.1016/j.lungcan.2004.07.998
- ↑ Thun MJ, Jemal A (outubro de 2006). «How much of the decrease in cancer death rates in the United States is attributable to reductions in tobacco smoking?». Tob Control. 15 (5): 345–7. PMC 2563648
 . PMID 16998161. doi:10.1136/tc.2006.017749
. PMID 16998161. doi:10.1136/tc.2006.017749 - ↑ Dubey S, Powell CA (maio de 2008). «Update in lung cancer 2007». Am. J. Respir. Crit. Care Med. 177 (9): 941–6. PMC 2720127
 . PMID 18434333. doi:10.1164/rccm.200801-107UP
. PMID 18434333. doi:10.1164/rccm.200801-107UP - ↑ Schütze M, Boeing H, Pischon T, Rehm J, Kehoe T, Gmel G, Olsen A, Tjønneland AM, Dahm CC, Overvad K, Clavel-Chapelon F, Boutron-Ruault MC, Trichopoulou A, Benetou V, Zylis D, Kaaks R, Rohrmann S, Palli D, Berrino F, Tumino R, Vineis P, Rodríguez L, Agudo A, Sánchez MJ, Dorronsoro M, Chirlaque MD, Barricarte A, Peeters PH, van Gils CH, Khaw KT, Wareham N, Allen NE, Key TJ, Boffetta P, Slimani N, Jenab M, Romaguera D, Wark PA, Riboli E, Bergmann MM (2011). «Alcohol attributable burden of incidence of cancer in eight European countries based on results from prospective cohort study». BMJ. 342: d1584. PMC 3072472
 . PMID 21474525. doi:10.1136/bmj.d1584
. PMID 21474525. doi:10.1136/bmj.d1584 - ↑ Irigaray P, Newby JA, Clapp R, Hardell L, Howard V, Montagnier L, Epstein S, Belpomme D (dezembro de 2007). «Lifestyle-related factors and environmental agents causing cancer: an overview». Biomed. Pharmacother. 61 (10): 640–58. PMID 18055160. doi:10.1016/j.biopha.2007.10.006
- ↑ a b «WHO calls for prevention of cancer through healthy workplaces» (Nota de imprensa). Organização Mundial da Saúde. 27 de abril de 2007. Consultado em 13 de outubro de 2007
- ↑ a b c Kushi LH, Byers T, Doyle C, Bandera EV, McCullough M, McTiernan A, Gansler T, Andrews KS, Thun MJ (2006). «American Cancer Society Guidelines on Nutrition and Physical Activity for cancer prevention: reducing the risk of cancer with healthy food choices and physical activity». CA Cancer J Clin. 56 (5): 254–81; quiz 313–4. PMID 17005596. doi:10.3322/canjclin.56.5.254
- ↑ Bhaskaran, K (2014). «Body mass index and risk of 22 specific cancers». Lancet. 384 (9945): 755–765. PMID 25129328. doi:10.1016/S0140-6736(14)60892-8
- ↑ Park S, Bae J, Nam BH, Yoo KY (2008). «Aetiology of cancer in Asia». Asian Pac. J. Cancer Prev. 9 (3): 371–80. PMID 18990005. Consultado em 15 de março de 2016. Arquivado do original (PDF) em 4 de setembro de 2011
- ↑ Brenner H, Rothenbacher D, Arndt V (2009). «Epidemiology of stomach cancer». Methods Mol. Biol. Methods in Molecular Biology. 472: 467–77. ISBN 978-1-60327-491-3. PMID 19107449. doi:10.1007/978-1-60327-492-0_23
- ↑ Buell P, Dunn JE (maio de 1965). «Cancer mortality among Japanese Issei and Nisei of California». Cancer. 18 (5): 656–64. PMID 14278899. doi:10.1002/1097-0142(196505)18:5<656::AID-CNCR2820180515>3.0.CO;2-3
- ↑ Pagano JS, Blaser M, Buendia MA, Damania B, Khalili K, Raab-Traub N, Roizman B (dezembro de 2004). «Infectious agents and cancer: criteria for a causal relation». Semin. Cancer Biol. 14 (6): 453–71. PMID 15489139. doi:10.1016/j.semcancer.2004.06.009
- ↑ Samaras V, Rafailidis PI, Mourtzoukou EG, Peppas G, Falagas ME (maio de 2010). «Chronic bacterial and parasitic infections and cancer: a review» (PDF). J Infect Dev Ctries. 4 (5): 267–81. PMID 20539059. doi:10.3855/jidc.819
- ↑ a b c d Little JB (2000). «Chapter 14: Ionizing Radiation». In: Kufe DW, Pollock RE, Weichselbaum RR, Bast RC Jr, Gansler TS, Holland JF, Frei E III. Cancer medicine 6th ed. Hamilton, Ont: B.C. Decker. ISBN 1-55009-113-1
- ↑ Brenner DJ, Hall EJ (novembro de 2007). «Computed tomography—an increasing source of radiation exposure». N. Engl. J. Med. 357 (22): 2277–84. PMID 18046031. doi:10.1056/NEJMra072149
- ↑ Cleaver JE, Mitchell DL (2000). «15. Ultraviolet Radiation Carcinogenesis». In: Bast RC, Kufe DW, Pollock RE; et al. Holland-Frei Cancer Medicine 5th ed. Hamilton, Ontario: B.C. Decker. ISBN 1-55009-113-1. Consultado em 31 de janeiro de 2011
- ↑ «IARC classifies radiofrequency electromagnetic fields as possibly carcinogenic to humans» (PDF). Organização Mundial da Saúde
- ↑ «Cell Phones and Cancer Risk - National Cancer Institute». Cancer.gov. 8 de maio de 2013. Consultado em 25 de dezembro de 2013
- ↑ a b Roukos DH (abril de 2009). «Genome-wide association studies: how predictable is a person's cancer risk?». Expert Rev Anticancer Ther. 9 (4): 389–92. PMID 19374592. doi:10.1586/era.09.12
- ↑ Cunningham D, Atkin W, Lenz HJ, Lynch HT, Minsky B, Nordlinger B, Starling N (março de 2010). «Colorectal cancer». Lancet. 375 (9719): 1030–47. PMID 20304247. doi:10.1016/S0140-6736(10)60353-4
- ↑ Maltoni CFM, Holland JF (2000). «Chapter 16: Physical Carcinogens». In: Bast RC, Kufe DW, Pollock RE; et al. Holland-Frei Cancer Medicine 5th ed. Hamilton, Ontario: B.C. Decker. ISBN 1-55009-113-1. Consultado em 31 de janeiro de 2011
- ↑ a b Gaeta, John F (2000). «Chapter 17: Trauma and Inflammation». In: Bast RC, Kufe DW, Pollock RE; et al. Holland-Frei Cancer Medicine 5th ed. Hamilton, Ontario: B.C. Decker. ISBN 1-55009-113-1. Consultado em 27 de janeiro de 2011
- ↑ Colotta, F.; Allavena, P.; Sica, A.; Garlanda, C.; Mantovani, A. (2009). «Cancer-related inflammation, the seventh hallmark of cancer: links to genetic instability». Carcinogenesis (review). 30 (7): 1073–1081. ISSN 0143-3334. PMID 19468060. doi:10.1093/carcin/bgp127
- ↑ Hendrik Ungefroren; Susanne Sebens; Daniel Seidl; Hendrik Lehnert; Ralf Haas (2011). «Interaction of tumor cells with the microenvironment». Cell Communication and Signaling. 9 (18). 18 páginas. doi:10.1186/1478-811X-9-18
- ↑ Mantovani A (junho de 2010). «Molecular pathways linking inflammation and cancer». Current Molecular Medicine (review). 10(4): 369–73. PMID 20455855. doi:10.2174/156652410791316968
- ↑ Borrello, Maria Grazia; Degl'Innocenti, Debora; Pierotti, Marco A. (2008). «Inflammation and cancer: The oncogene-driven connection». Cancer Letters (review). 267 (2): 262–270. ISSN 0304-3835. PMID 18502035. doi:10.1016/j.canlet.2008.03.060
- ↑ a b c Henderson BE, Bernstein L, Ross RK (2000). «Chapter 13: Hormones and the Etiology of Cancer». In: Bast RC, Kufe DW, Pollock RE; et al. Holland-Frei Cancer Medicine 5th ed. Hamilton, Ontario: B.C. Decker. ISBN 1-55009-113-1. Consultado em 27 de janeiro de 2011
- ↑ Rowlands, Mari-Anne; Gunnell, David; Harris, Ross; Vatten, Lars J; Holly, Jeff MP; Martin, Richard M (15 de maio de 2009). «Circulating insulin-like growth factor peptides and prostate cancer risk: a systematic review and meta-analysis». Int J Cancer. 124 (10): 2416–29. PMC 2743036
 . PMID 19142965. doi:10.1002/ijc.24202
. PMID 19142965. doi:10.1002/ijc.24202 - ↑ a b c d e f Scott, Gilbert (2010). Developmental Biology. USA: Sinauer Associates
- ↑ Souza, Waldemir Fernandes de (2009). «E-caderina» (PDF). Perda da adesão célula-célula mediada pela E-caderina em câncer colo-retal: vias de sinalização envolvidas. Consultado em 25 de junho de 2016
- ↑ Rubin, Lee. «Targeting the Hedgehog pathway in cancer». Nature Reviews Drug Discovery. Consultado em 26 de junho de 2016
- ↑ Centro de Combate ao Câncer (ed.). «Sintomas e diagnóstico». Consultado em 19 de março de 2016
- ↑ «Cancer Glossary». cancer.org. American Cancer Society. Consultado em 11 de setembro de 2013
- ↑ «What is cancer?». cancer.gov. National Cancer Institute. Consultado em 11 de setembro de 2013
- ↑ Hanahan, D; Weinberg, RA (7 de janeiro de 2000). «The hallmarks of cancer.». Cell. 100 (1): 57–70. PMID 10647931. doi:10.1016/s0092-8674(00)81683-9
- ↑ a b c Hanahan, Douglas; Weinberg, Robert A. (7 de janeiro de 2000). «The hallmarks of cancer». Cell. 100 (1): 57–70. PMID 10647931. doi:10.1016/S0092-8674(00)81683-9
- ↑ a b Hanahan, Douglas; Weinberg, Robert A. (2011). «Hallmarks of Cancer: The Next Generation». Cell. 144 (5): 646–74. PMID 21376230. doi:10.1016/j.cell.2011.02.013
- ↑ a b c d Jemal A, Murray T, Ward E, Samuels A, Tiwari RC, Ghafoor A, Feuer EJ, Thun MJ (2005). «Cancer statistics, 2005». CA Cancer J Clin. 55 (1): 10-30. PMID 15661684. Consultado em 6 de julho de 2007. Arquivado do original em 26 de dezembro de 2008
- ↑ Dalmasso P, Pastore G, Zuccolo L, Maule MM, Pearce N, Merletti F, Magnani C (2005). «Temporal trends in the incidence of childhood leukemia, lymphomas and solid tumors in north-west Italy,. A report of the Childhood Cancer Registry of Piedmont». Haematologica. 90 (9): 1197-204. PMID
- ↑ Agha M, Dimonte B, Greenberg M, Greenberg C, Barr R, McLaughlin JR (2005). «Incidence trends and projections for childhood cancer in Ontario». Int J Cancer. PMID
- ↑ Sausville, Edward A. and Longo, Dan L. "Principles of Cancer Treatment: Surgery, Chemotherapy, and Biologic Therapy", Harrison's Principles of Internal Medicine, 16th Ed. Kaspar, Dennis L. et al., eds. p.446 (2005).
- ↑ Croce CM (janeiro de 2008). «Oncogenes and cancer». N. Engl. J. Med. 358 (5): 502–11. PMID 18234754. doi:10.1056/NEJMra072367
- ↑ Knudson AG (novembro de 2001). «Two genetic hits (more or less) to cancer». Nature Reviews Cancer. 1 (2): 157–62. PMID 11905807. doi:10.1038/35101031
- ↑ Nelson DA, Tan TT, Rabson AB, Anderson D, Degenhardt K, White E (setembro de 2004). «Hypoxia and defective apoptosis drive genomic instability and tumorigenesis». Genes & Development. 18 (17): 2095–107. PMC 515288
 . PMID 15314031. doi:10.1101/gad.1204904
. PMID 15314031. doi:10.1101/gad.1204904 - ↑ Merlo LM, Pepper JW, Reid BJ, Maley CC (dezembro de 2006). «Cancer as an evolutionary and ecological process». Nature Reviews Cancer. 6 (12): 924–35. PMID 17109012. doi:10.1038/nrc2013
- ↑ Baylin SB, Ohm JE (fevereiro de 2006). «Epigenetic gene silencing in cancer - a mechanism for early oncogenic pathway addiction?». Nature Reviews Cancer. 6 (2): 107–16. PMID 16491070. doi:10.1038/nrc1799
- ↑ Kanwal, R; Gupta, S (2012). «Epigenetic modifications in cancer». Clinical Genetics. 81 (4): 303–11. PMC 3590802
 . PMID 22082348. doi:10.1111/j.1399-0004.2011.01809.x
. PMID 22082348. doi:10.1111/j.1399-0004.2011.01809.x - ↑ Baldassarre, G; Battista, S; Belletti, B; Thakur, S; Pentimalli, F; Trapasso, F; Fedele, M; Pierantoni, G; Croce, CM; Fusco, A (2003). «Negative regulation of BRCA1 gene expression by HMGA1 proteins accounts for the reduced BRCA1 protein levels in sporadic breast carcinoma». Molecular and Cellular Biology. 23 (7): 2225–38. PMC 150734
 . PMID 12640109. doi:10.1128/MCB.23.7.2225-2238.2003/
. PMID 12640109. doi:10.1128/MCB.23.7.2225-2238.2003/ - ↑ Jacinto FV, Esteller M (julho de 2007). «Mutator pathways unleashed by epigenetic silencing in human cancer». Mutagenesis. 22 (4): 247–53. PMID 17412712. doi:10.1093/mutage/gem009
- ↑ Lahtz C, Pfeifer GP (fevereiro de 2011). «Epigenetic changes of DNA repair genes in cancer». J Mol Cell Biol. 3 (1): 51–8. PMC 3030973
 . PMID 21278452. doi:10.1093/jmcb/mjq053
. PMID 21278452. doi:10.1093/jmcb/mjq053 - ↑ Bernstein C, Nfonsam V, Prasad AR, Bernstein H (março de 2013). «Epigenetic field defects in progression to cancer». World J Gastrointest Oncol. 5 (3): 43–9. PMC 3648662
 . PMID 23671730. doi:10.4251/wjgo.v5.i3.43
. PMID 23671730. doi:10.4251/wjgo.v5.i3.43 - ↑ Bernstein, Carol; Prasad, Anil R.; Nfonsam, Valentine; Bernstein, Harris (2013). «DNA Damage, DNA Repair and Cancer». In: Prof. Clark Chen (Ed.). New Research Directions in DNA Repair. [S.l.]: InTech. ISBN 978-953-51-1114-6. doi:10.5772/53919
- ↑ Malkin, D (2011). «Li-fraumeni syndrome». Genes & cancer. 2 (4): 475–84. PMC 3135649
 . PMID 21779515. doi:10.1177/1947601911413466
. PMID 21779515. doi:10.1177/1947601911413466 - ↑ Vogelstein, B; Papadopoulos, N; Velculescu, VE; Zhou, S; Diaz Jr, LA; Kinzler, KW (2013). «Cancer genome landscapes». Science. 339 (6127): 1546–58. PMC 3749880
 . PMID 23539594. doi:10.1126/science.1235122
. PMID 23539594. doi:10.1126/science.1235122 - ↑ a b «Metastatic Cancer: Questions and Answers». National Cancer Institute. Consultado em 28 de agosto de 2008
- ↑ «What is Metastasized Cancer?». National Comprehensive Cancer Network. Consultado em 18 de julho de 2013. Arquivado do original em 3 de março de 2013
- ↑ Lind M.J., M.J. (2008). «Principles of cytotoxic chemotherapy». Medicine. 36 (1): 19–23. doi:10.1016/j.mpmed.2007.10.003
- ↑ National Cancer Institute (dezembro de 2012). «Targeted Cancer Therapies». www.cancer.gov. Consultado em 9 de março de 2014
- ↑ NCI: Targeted Therapy tutorials. Acessado em 18-3-2016.
- ↑ Morgan, Graeme; Ward, Robyn; Barton, Michael (2004). «The contribution of cytotoxic chemotherapy to 5-year survival in adult malignancies». Clinical Oncology (Royal College of Radiologists (Great Britain)). 16 (8): 549–560. ISSN 0936-6555. PMID 15630849
- ↑ Gebremedhn, Endale Gebreegziabher; Shortland, Peter John; Mahns, David Anthony (12 de abril de 2018). «The incidence of acute oxaliplatin-induced neuropathy and its impact on treatment in the first cycle: a systematic review». BMC cancer. 18 (1). 410 páginas. ISSN 1471-2407. PMID 29649985. doi:10.1186/s12885-018-4185-0
- ↑ Morgan, Graeme; Ward, Robyn; Barton, Michael (2004). «The contribution of cytotoxic chemotherapy to 5-year survival in adult malignancies». Clinical Oncology (Royal College of Radiologists (Great Britain)). 16 (8): 549–560. ISSN 0936-6555. PMID 15630849
- ↑ a b Holland Chp. 40
- ↑ Nastoupil, LJ; Rose, AC; Flowers, CR (maio de 2012). «Diffuse large B-cell lymphoma: current treatment approaches». Oncology (Williston Park, N.Y.). 26 (5): 488–95. PMID 22730604
- ↑ Freedman, A (outubro de 2012). «Follicular lymphoma: 2012 update on diagnosis and management». American journal of hematology. 87 (10): 988–95. PMID 23001911. doi:10.1002/ajh.23313
- ↑ Rampling, R; James, A; Papanastassiou, V (junho de 2004). «The present and future management of malignant brain tumours: surgery, radiotherapy, chemotherapy». Journal of neurology, neurosurgery, and psychiatry. 75 Suppl 2 (Suppl 2): ii24–30. PMC 1765659
 . PMID 15146036. doi:10.1136/jnnp.2004.040535
. PMID 15146036. doi:10.1136/jnnp.2004.040535 - ↑ Madan, V; Lear, JT; Szeimies, RM (20 de fevereiro de 2010). «Non-melanoma skin cancer». Lancet. 375 (9715): 673–85. PMID 20171403. doi:10.1016/S0140-6736(09)61196-X
- ↑ CK Bomford, IH Kunkler, J Walter. Walter and Miller's Textbook of Radiation therapy (6th Ed), p311
- ↑ "Radiosensitivity" on GP notebook http://www.gpnotebook.co.uk/simplepage.cfm?ID=2060451853
- ↑ "Radiation therapy- what GPs need to know" on patient.co.uk http://www.patient.co.uk/showdoc/40002299/
- ↑ Hill, R; Healy, B; Holloway, L; Kuncic, Z; Thwaites, D; Baldock, C (21-3- 2014). «Advances in kilovoltage x-ray beam dosimetry.». Physics in medicine and biology. 59 (6): R183-231. PMID 24584183. doi:10.1088/0031-9155/59/6/r183Verifique data em:
|data=(ajuda) - ↑ a b Holland Chp. 41
- ↑ American Society of Clinical Oncology. «Five Things Physicians and Patients Should Question» (PDF). American Society of Clinical Oncology. Choosing Wisely: an initiative of the ABIM Foundation. Consultado em 14 de agosto de 2012. Arquivado do original (PDF) em 31 de julho de 2012
- ↑ «NCCN Guidelines»
- ↑ «Clinical Practice Guidelines for Quality Palliative Care» (PDF). The National Consensus Project for Quality Palliative Care (NCP). Consultado em 16 de março de 2016. Arquivado do original (PDF) em 16 de maio de 2011
- ↑ Levy MH, Back, A, Bazargan, S, Benedetti, C, Billings, JA, Block, S, Bruera, E, Carducci, MA, Dy, S, Eberle, C, Foley, KM, Harris, JD, Knight, SJ, Milch, R, Rhiner, M, Slatkin, NE, Spiegel, D, Sutton, L, Urba, S, Von Roenn, JH, Weinstein, SM, National Comprehensive Cancer Network (setembro de 2006). «Palliative care. Clinical practice guidelines in oncology». Journal of the National Comprehensive Cancer Network: JNCCN. 4 (8): 776–818. PMID 16948956
- ↑ Waldmann, TA (março de 2003). «Immunotherapy: past, present and future.». Nature Medicine. 9 (3): 269–77. PMID 12612576. doi:10.1038/nm0303-269
- ↑ Met, Özcan; Jensen, Kasper Mølgaard; Chamberlain, Christopher Aled; Donia, Marco; Svane, Inge Marie (2018). «Principles of adoptive T cell therapy in cancer». Seminars in Immunopathology. ISSN 1863-2300. doi:10.1007/s00281-018-0703-z
- ↑ Instituto Nacional do Câncer (INCA) (ed.). «Imunoterapia». Consultado em 18 de março de 2016
- ↑ Cassileth BR, Deng G (2004). «Complementary and alternative therapies for cancer». Oncologist. 9 (1): 80–9. PMID 14755017. doi:10.1634/theoncologist.9-1-80
- ↑ What Is CAM? National Center for Complementary and Alternative Medicine. Acessado em 3 de fevereiro de 2008.
- ↑ Collier, Roger (3 de fevereiro de 2009). «Drug development cost estimates hard to swallow». CMAJ : Canadian Medical Association Journal. 180 (3): 279–280. ISSN 0820-3946. PMID 19188620. doi:10.1503/cmaj.082040
- ↑ Instituto Nacional do Câncer (INCA) (ed.). «Medicina não-convencional:prevalência em pacientes oncológicos» (PDF). Consultado em 18 de março de 2016
- ↑ Ornish, Dean; Weidner, Gerdi; Fair, William R.; Marlin, Ruth; Pettengill, Elaine B.; Raisin, Caren J.; Dunn-Emke, Stacey; Crutchfield, Lila; Jacobs, F. Nicholas (2005). «Intensive lifestyle changes may affect the progression of prostate cancer». The Journal of Urology. 174 (3): 1065–1069; discussion 1069–1070. ISSN 0022-5347. PMID 16094059. doi:10.1097/01.ju.0000169487.49018.73
- ↑ Ornish, Dean; Magbanua, Mark Jesus M.; Weidner, Gerdi; Weinberg, Vivian; Kemp, Colleen; Green, Christopher; Mattie, Michael D.; Marlin, Ruth; Simko, Jeff (17 de junho de 2008). «Changes in prostate gene expression in men undergoing an intensive nutrition and lifestyle intervention». Proceedings of the National Academy of Sciences of the United States of America. 105 (24): 8369–8374. ISSN 0027-8424. PMID 18559852. doi:10.1073/pnas.0803080105
- ↑ Campbell, T. Colin (2017). «Cancer Prevention and Treatment by Wholistic Nutrition». Journal of Nature and Science. 3 (10). ISSN 2377-2700. PMID 29057328
- ↑ «Natural products in anticancer therapy». Current Opinion in Pharmacology (em inglês). 1 (4): 364–369. 1 de agosto de 2001. ISSN 1471-4892. doi:10.1016/S1471-4892(01)00063-7
- ↑ «Isoxazoline containing natural products as anticancer agents: A review». European Journal of Medicinal Chemistry (em inglês). 77: 121–133. 22 de abril de 2014. ISSN 0223-5234. doi:10.1016/j.ejmech.2014.02.063
- ↑ «Anticancer polysaccharides from natural resources: A review of recent research». Carbohydrate Polymers (em inglês). 90(4): 1395–1410. 6 de novembro de 2012. ISSN 0144-8617. doi:10.1016/j.carbpol.2012.07.026
- ↑ Guo, B.; Wang, Y.; Sun, X.; Tang, K. (2008). «Bioactive natural products from endophytes: A review». Applied Biochemistry and Microbiology (em inglês). 44 (2): 136–142. ISSN 0003-6838. doi:10.1134/s0003683808020026
- ↑ Hansen, Laura (2000). «Terapia de diferenciação» (PDF). Retinoids in chemoprevention and differentiation therapy. Carcinogenesis. Consultado em 26 de junho de 2016
- ↑ World Cancer Report 2014. [S.l.]: Organização Mundial da Saúde. 2014. p. 22. ISBN 9283204298
- ↑ Instituto Nacional do Câncer (INCA) (ed.). «Sobrevida, estadiamento relação incidência/mortalidade» (PDF). Consultado em 18 de março de 2016
- ↑ a b Rheingold, Susan; Neugut, Alfred; Meadows, Anna (2003). «156: Secondary Cancers: Incidence, Risk Factors, and Management». In: Frei, Emil; Kufe, Donald W.; Holland, James F. Holland-Frei Cancer Medicine 6th ed. Hamilton, Ont: BC Decker. p. 2399. ISBN 1-55009-213-8. Consultado em 5 de novembro de 2009
- ↑ Montazeri A (dezembro de 2009). «Quality of life data as prognostic indicators of survival in cancer patients: an overview of the literature from 1982 to 2008». Health Qual Life Outcomes. 7: 102. PMC 2805623
 . PMID 20030832. doi:10.1186/1477-7525-7-102
. PMID 20030832. doi:10.1186/1477-7525-7-102 - ↑ Akl, EA; Kahale, LA; Ballout, RA; Barba, M; Yosuico, VE; van Doormaal, FF; Middeldorp, S; Bryant, A; Schünemann, H (10 de dezembro de 2014). «Parenteral anticoagulation in ambulatory patients with cancer.». The Cochrane database of systematic reviews. 12: CD006652. PMID 25491949. doi:10.1002/14651858.CD006652.pub4
- ↑ «Cancer prevention: 7 steps to reduce your risk». Mayo Clinic. 27 de setembro de 2008. Consultado em 30 de janeiro de 2010
- ↑ Danaei G, Vander Hoorn S, Lopez AD, Murray CJ, Ezzati M (2005). «Causes of cancer in the world: comparative risk assessment of nine behavioural and environmental risk factors». Lancet. 366 (9499): 1784–93. PMID 16298215. doi:10.1016/S0140-6736(05)67725-2
- ↑ Wu, S; Powers, S; Zhu, W; Hannun, YA (16 de dezembro de 2015). «Substantial contribution of extrinsic risk factors to cancer development.». Nature. PMID 26675728. doi:10.1038/nature16166
- ↑ «Cancer». Organização Mundial da Saúde. Consultado em 9 de janeiro de 2011
- ↑ a b Wicki A, Hagmann, J (setembro de 2011). «Diet and cancer». Swiss medical weekly. 141: w13250. PMID 21904992. doi:10.4414/smw.2011.13250
- ↑ Cappellani A, Di Vita M, Zanghi A, Cavallaro A, Piccolo G, Veroux M, Berretta M, Malaguarnera M, Canzonieri V, Lo Menzo E (2012). «Diet, obesity and breast cancer: an update». Front Biosci (Schol Ed). 4: 90–108. PMID 22202045
- ↑ Key TJ (janeiro de 2011). «Fruit and vegetables and cancer risk». Br. J. Cancer. 104 (1): 6–11. PMC 3039795
 . PMID 21119663. doi:10.1038/sj.bjc.6606032
. PMID 21119663. doi:10.1038/sj.bjc.6606032 - ↑ Wang, X; Ouyang, Y; Liu, J; Zhu, M; Zhao, G; Bao, W; Hu, FB (29 de julho de 2014). «Fruit and vegetable consumption and mortality from all causes, cardiovascular disease, and cancer: systematic review and dose-response meta-analysis of prospective cohort studies.». BMJ (Clinical research ed.). 349: g4490. PMC 4115152
 . PMID 25073782. doi:10.1136/bmj.g4490
. PMID 25073782. doi:10.1136/bmj.g4490 - ↑ Larsson SC, Wolk A (maio de 2007). «Coffee consumption and risk of liver cancer: a meta-analysis». Gastroenterology. 132(5): 1740–5. PMID 17484871. doi:10.1053/j.gastro.2007.03.044
- ↑ Zheng W, Lee SA (2009). «Well-done meat intake, heterocyclic amine exposure, and cancer risk». Nutr Cancer. 61 (4): 437–46. PMC 2769029
 . PMID 19838915. doi:10.1080/01635580802710741
. PMID 19838915. doi:10.1080/01635580802710741 - ↑ Ferguson LR (fevereiro de 2010). «Meat and cancer». Meat Sci. 84 (2): 308–13. PMID 20374790. doi:10.1016/j.meatsci.2009.06.032
- ↑ Staff (26 de outubro de 2015). «World Health Organization - IARC Monographs evaluate consumption of red meat and processed meat» (PDF). Agência Internacional de Pesquisa em Câncer. Consultado em 26 de outubro de 2015
- ↑ Hauser, Christine (26 de outubro de 2015). «W.H.O. Report Links Some Cancers With Processed or Red Meat». New York Times. Consultado em 26 de outubro de 2015
- ↑ Holland Chp.33
- ↑ Rostom A, Dubé C, Lewin G, Tsertsvadze A, Barrowman N, Code C, Sampson M, Moher D (março de 2007). «Nonsteroidal anti-inflammatory drugs and cyclooxygenase-2 inhibitors for primary prevention of colorectal cancer: a systematic review prepared for the U.S. Preventive Services Task Force». Annals of Internal Medicine. 146 (5): 376–89. PMID 17339623. doi:10.7326/0003-4819-146-5-200703060-00010
- ↑ Rothwell PM, Fowkes FG, Belch JF, Ogawa H, Warlow CP, Meade TW (janeiro de 2011). «Effect of daily aspirin on long-term risk of death due to cancer: analysis of individual patient data from randomised trials». Lancet. 377 (9759): 31–41. PMID 21144578. doi:10.1016/S0140-6736(10)62110-1
- ↑ Cooper K, Squires H, Carroll C, Papaioannou D, Booth A, Logan RF, Maguire C, Hind D, Tappenden P (junho de 2010). «Chemoprevention of colorectal cancer: systematic review and economic evaluation». Health Technol Assess. 14 (32): 1–206. PMID 20594533. doi:10.3310/hta14320
- ↑ Thomsen A, Kolesar JM (dezembro de 2008). «Chemoprevention of breast cancer». Am J Health Syst Pharm. 65 (23): 2221–8. PMID 19020189. doi:10.2146/ajhp070663
- ↑ Wilt TJ, MacDonald R, Hagerty K, Schellhammer P, Kramer BS (2008). Wilt, Timothy J, ed. «Five-alpha-reductase Inhibitors for prostate cancer prevention». Cochrane Database Syst Rev (2): CD007091. PMID 18425978. doi:10.1002/14651858.CD007091
- ↑ «Vitamins and minerals: not for cancer or cardiovascular prevention». Prescrire Int. 19 (108): 182. Agosto de 2010. PMID 20939459
- ↑ Giovannucci E, Liu Y, Rimm EB, Hollis BW, Fuchs CS, Stampfer MJ, Willett WC (abril de 2006). «Prospective study of predictors of vitamin D status and cancer incidence and mortality in men». J. Natl. Cancer Inst. 98 (7): 451–9. PMID 16595781. doi:10.1093/jnci/djj101
- ↑ «Vitamin D Has Role in Colon Cancer Prevention». Consultado em 27 de julho de 2007. Arquivado do original em 13 de abril de 2009
- ↑ Schwartz GG, Blot WJ (abril de 2006). «Vitamin D status and cancer incidence and mortality: something new under the sun». J. Natl. Cancer Inst. 98 (7): 428–30. PMID 16595770. doi:10.1093/jnci/djj127
- ↑ Fritz H, Kennedy D, Fergusson D, Fernandes R, Doucette S, Cooley K, Seely A, Sagar S, Wong R, Seely D (2011). Minna, John D, ed. «Vitamin A and retinoid derivatives for lung cancer: a systematic review and meta analysis». PLoS ONE. 6 (6): e21107. Bibcode:2011PLoSO...6E1107F. PMC 3124481
 . PMID 21738614. doi:10.1371/journal.pone.0021107
. PMID 21738614. doi:10.1371/journal.pone.0021107 - ↑ Cole BF, Baron JA, Sandler RS, Haile RW, Ahnen DJ, Bresalier RS, McKeown-Eyssen G, Summers RW, Rothstein RI, Burke CA, Snover DC, Church TR, Allen JI, Robertson DJ, Beck GJ, Bond JH, Byers T, Mandel JS, Mott LA, Pearson LH, Barry EL, Rees JR, Marcon N, Saibil F, Ueland PM, Greenberg ER (junho de 2007). «Folic acid for the prevention of colorectal adenomas: a randomized clinical trial». JAMA. 297 (21): 2351–9. PMID 17551129. doi:10.1001/jama.297.21.2351
- ↑ Vinceti, M; Dennert, G; Crespi, CM; Zwahlen, M; Brinkman, M; Zeegers, MP; Horneber, M; D'Amico, R; Del Giovane, C (30 de março de 2014). «Selenium for preventing cancer.». The Cochrane database of systematic reviews. 3: CD005195. PMID 24683040. doi:10.1002/14651858.CD005195.pub3
- ↑ a b c «Cancer Vaccine Fact Sheet». NCI. 8 de junho de 2006. Consultado em 15 de novembro de 2008. Arquivado do original em 25 de outubro de 2008
- ↑ a b Lertkhachonsuk AA, Yip CH, Khuhaprema T, Chen DS, Plummer M, Jee SH, Toi M, Wilailak S (2013). «Cancer prevention in Asia: resource-stratified guidelines from the Asian Oncology Summit 2013». Lancet Oncology. 14 (12): e497-507. PMID 24176569. doi:10.1016/S1470-2045(13)70350-4
- ↑ a b «What Is Cancer Screening?». National Cancer Institute
- ↑ a b Wilson JMG, Jungner G. (1968) Principles and practice of screening for disease. Geneva:Organização Mundial da Saúde. Public Health Papers, #34.
- ↑ «Screening for Cervical Cancer». U.S. Preventive Services Task Force. 2003
- ↑ «Screening for Colorectal Cancer». U.S. Preventive Services Task Force. 2008
- ↑ «Screening for Skin Cancer». U.S. Preventive Services Task Force. 2009
- ↑ «Screening for Oral Cancer». U.S. Preventive Services Task Force. 2004
- ↑ «Lung Cancer Screening». U.S. Preventive Services Task Force. 2004
- ↑ «Screening for Prostate Cancer». U.S. Preventive Services Task Force. 2008
- ↑ «Screening for Breast Cancer». U.S. Preventive Services Task Force. 2009
- ↑ Gøtzsche PC, Nielsen M (2011). Gøtzsche, Peter C, ed. «Screening for breast cancer with mammography». Cochrane Database Syst Rev (1): CD001877. PMID 21249649. doi:10.1002/14651858.CD001877.pub4
- ↑ a b Gulati AP, Domchek, SM (janeiro de 2008). «The clinical management of BRCA1 and BRCA2 mutation carriers». Current oncology reports. 10 (1): 47–53. PMID 18366960. doi:10.1007/s11912-008-0008-9
- ↑ «WHO Disease and injury country estimates». Organização Mundial da Saúde. 2009. Consultado em 11 de novembro de 2009
- ↑ a b Lozano, R; Mohsen, N; Foreman, K; Lim, S; Shibuya, K; Aboyans, V; Abraham, J; Adair, T; Aggarwal, R; Ahn, SY; AlMazroa, MA; Alvarado, M; Anderson, HR; Anderson, LM; Andrews, KG; Atkinson, C; Baddour, LM; Barker-Collo, S; Bartels, DH; Bell, ML; Benjamin, EJ; Bennett, D; Bhalla, K; Bikbov, B; Bin Abdulhak, A; Birbeck, G; Blyth, F; Bolliger, I; Boufous, S; Bucello, C (15 de dezembro de 2012). «Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010». Lancet. 380 (9859): 2095–128. PMID 23245604. doi:10.1016/S0140-6736(12)61728-0
- ↑ WHO (outubro de 2010). «Cancer». Organização Mundial da Saúde. Consultado em 5 de janeiro de 2011
- ↑ a b Coleman, William B. and Rubinas, Tara C. (2009). «4». In: Tsongalis, Gregory J. and Coleman, William L. Molecular Pathology: The Molecular Basis of Human Disease. Amsterdam: Elsevier Academic Press. p. 66. ISBN 0-12-374419-9
- ↑ Johnson, George (28 de dezembro de 2010). «Unearthing Prehistoric Tumors, and Debate». The New York Times
- ↑ Pawelec G, Derhovanessian, E, Larbi, A (agosto de 2010). «Immunosenescence and cancer». Critical reviews in oncology/hematology. 75 (2): 165–72. PMID 20656212. doi:10.1016/j.critrevonc.2010.06.012
- ↑ Alberts, B, Johnson A, Lewis J; et al. (2002). «The Preventable Causes of Cancer». Molecular biology of the cell 4th ed. New York: Garland Science. ISBN 0-8153-4072-9
- ↑ Anisimov VN, Sikora, E, Pawelec, G (agosto de 2009). «Relationships between cancer and aging: a multilevel approach». Biogerontology. 10 (4): 323–38. PMID 19156531. doi:10.1007/s10522-008-9209-8
- ↑ de Magalhaes JP (2013). «How ageing processes influence cancer». Nature Reviews Cancer. 13 (5): 357–65. PMID 23612461. doi:10.1038/nrc3497
- ↑ Fraumeni, Joseph F.; Schottenfeld, David; Marshall, James M. (2006). Cancer epidemiology and prevention. Oxford [Oxfordshire]: Oxford University Press. p. 977. ISBN 0-19-514961-0
- ↑ Bostwick, David G.; Eble, John N. (2007). Urological Surgical Pathology. St. Louis: Mosby. p. 468. ISBN 0-323-01970-6
- ↑ a b Kaatsch P, Sikora, E, Pawelec, G (junho de 2010). «Epidemiology of childhood cancer». Cancer treatment reviews. 36 (4): 277–85. PMID 20231056. doi:10.1016/j.ctrv.2010.02.003
- ↑ a b Ward, Elizabeth; DeSantis, Carol; Robbins, Anthony; Kohler, Betsy; Jemal, Ahmedin (janeiro de 2014). «Childhood and adolescent cancer statistics, 2014». CA: A Cancer Journal for Clinicians. 64: n/a–n/a. PMID 24488779. doi:10.3322/caac.21219
- ↑ Ward EM, Thun, MJ, Hannan, LM, Jemal, A (setembro de 2006). «Interpreting cancer trends». Annals of the New York Academy of Sciences. 1076: 29–53. Bibcode:2006NYASA1076...29W. PMID 17119192. doi:10.1196/annals.1371.048
- ↑ «Cancro causou 27.900 mortes em 2016 em Portugal»
- ↑ a b c d e f Hajdu SI, Thun, MJ, Hannan, LM, Jemal, A (março de 2011). «A note from history: landmarks in history of cancer, part 1». Cancer. 117 (5): 1097–102. PMID 20960499. doi:10.1002/cncr.25553
- ↑ Paul of Aegina, 7th Century AD, citado em Moss, Ralph W. (2004). «Galen on Cancer». CancerDecisions. Arquivado do original em 11 de janeiro de 2012 Referenced from Michael Shimkin, Contrary to Nature, Washington, D.C.: Superintendent of Document, DHEW Publication No. (NIH) 79-720, p. 35.
- ↑ Majno, Guido; Joris, Isabelle (12 de agosto de 2004). Cells, Tissues, and Disease : Principles of General Pathology: Principles of General Pathology. [S.l.]: Oxford University Press. ISBN 978-0-19-974892-1. Consultado em 11 de setembro de 2013
- ↑ a b Hajdu SI, Thun, MJ, Hannan, LM, Jemal, A (junho de 2011). «A note from history: landmarks in history of cancer, part 2». Cancer. 117 (12): 2811–20. PMID 21656759. doi:10.1002/cncr.25825
- ↑ Yalom, Marilyn (1998). A history of the breast 1st Ballantine Books ed. New York: Ballantine Books. ISBN 0-679-43459-3
- ↑ Hajdu SI, Thun, MJ, Hannan, LM, Jemal, A (julho de 2011). «A note from history: Landmarks in history of cancer, part 3». Cancer. 118 (4): 1155–68. PMID 21751192. doi:10.1002/cncr.26320
- ↑ Grange JM, Stanford JL, Stanford CA (2002). «Campbell De Morgan's 'Observations on cancer', and their relevance today». Journal of the Royal Society of Medicine. 95 (6): 296–9. PMC 1279913
 . PMID 12042378. doi:10.1258/jrsm.95.6.296
. PMID 12042378. doi:10.1258/jrsm.95.6.296 - ↑ «What Is Cancer?». National Cancer Institute. Consultado em 17 de agosto de 2009
- ↑ «Cancer Fact Sheet». Agency for Toxic Substances & Disease Registry. 30 de agosto de 2002. Consultado em 17 de agosto de 2009
- ↑ Wanjek, Christopher (16 de setembro de 2006). «Exciting New Cancer Treatments Emerge Amid Persistent Myths». Consultado em 17 de agosto de 2009
- ↑ Hayden EC, Thun, MJ, Hannan, LM, Jemal, A (abril de 2009). «Cutting off cancer's supply lines». Nature. 458 (7239): 686–687. PMID 19360048. doi:10.1038/458686b
- ↑ Bagri, A; Kouros-Mehr, Hosein; Leong, KG; Plowman, GD (março de 2010). «Use of anti-VEGF adjuvant therapy in cancer: challenges and rationale.». Trends in molecular medicine. 16 (3): 122–32. PMID 20189876. doi:10.1016/j.molmed.2010.01.004
- ↑ Sleigh SH, Barton CL (2010). «Repurposing Strategies for Therapeutics». Pharm Med. 24 (3): 151–159. doi:10.2165/11536770-000000000-00000
- ↑ Winther H, Jorgensen JT (2010). «Drug-Diagnostic Co-Development in Cancer». Pharm Med. 24 (6): 363–375. doi:10.2165/11586320-000000000-00000
- ↑ Sharon Begley (16 de setembro de 2008). «Rethinking the War on Cancer». Newsweek. Consultado em 8 de setembro de 2008. Cópia arquivada em 10 de setembro de 2008
|deadurl=e|urlmorta=redundantes (ajuda) - ↑ Kolata, Gina (23 de abril de 2009). «Advances Elusive in the Drive to Cure Cancer». The New York Times. Consultado em 5 de maio de 2009
- ↑ Bruce Albertsa, Marc W. Kirschnerb, Shirley Tilghmanc, and Harold Varmus, Rescuing US biomedical research from its systemic flaws, Proceedings of the National Academy of Sciences of the United States of America, vol. 111 no. 16, April 2014
- ↑ Kolata, Gina (23 de abril de 2009). «Advances Elusive in the Drive to Cure Cancer». The New York Times. Consultado em 29 de dezembro de 2009
- ↑ Kolata, Gina (27 de junho de 2009). «Grant System Leads Cancer Researchers to Play It Safe». The New York Times. Consultado em 29 de dezembro de 2009
- ↑ Leaf, Clifton (22 de março de 2004). «Why We're Losing The War On Cancer». Fortune Magazine (CNN Money)
- ↑ Ehrenreich, Barbara (novembro de 2001). «Welcome to Cancerland». Harper's Magazine. ISSN 0017-789X. Arquivado do original em 6 de julho de 2015
- ↑ Rapini, Ronald P.; Bolognia, Jean L.; Jorizzo, Joseph L. (2007). Dermatology: 2-Volume Set. St. Louis: Mosby. ISBN 1-4160-2999-0
- ↑ «Skin cancers». Organização Mundial da Saúde. Consultado em 19 de janeiro de 2011
- ↑ McCulley, Michelle; Greenwell, Pamela (2007). Molecular therapeutics: 21st-century medicine. London: J. Wiley. p. 207. ISBN 0-470-01916-6
- ↑ Huang, Carolina (10 de abril de 2005). «A metáfora no texto científico de medicina» (PDF). Instituto de Letras da UFRGS: Universidade Federal do Rio Grande do Sul. Consultado em 31 de março de 2016
- ↑ Sant'Anna, P. A. (10 de novembro de 1996). «Um Estudo dos arquétipos nos sonhos de portadores do HIV» (PDF). Instituto de Psicologia da Universidade de São Paulo: Universidade de São Paulo. Consultado em 31 de março de 2016
- ↑ Gwyn, Richard (1999). «10». In: Cameron, Lynne; Low, Graham. Researching and applying metaphor. Cambridge, UK: Cambridge University Press. ISBN 0-521-64964-1
- ↑ Sulik, Gayle (2010). Pink Ribbon Blues: How Breast Cancer Culture Undermines Women's Health. New York: Oxford University Press. pp. 78–89. ISBN 0-19-974045-3. OCLC 535493589
- ↑ a b Olson, James Stuart (2002). Bathsheba's Breast: Women, Cancer and History. Baltimore: The Johns Hopkins University Press. pp. 145–170. ISBN 0-8018-6936-6. OCLC 186453370
- ↑ a b Ehrenreich, Barbara (2009). Bright-sided: How the Relentless Promotion of Positive Thinking Has Undermined America. New York: Metropolitan Books. pp. 15–44. ISBN 0-8050-8749-4
- ↑ «Cancer Facts and Figures 2012». Journalist's Resource.org
- ↑ Revista Veja, ed. (29 de setembro de 2012). «Europa gasta mais de 100 bilhões de euros ao ano com câncer». Consultado em 18 de março de 2016
- ↑ Instituto Nacional do Câncer (INCA), ed. (27 de janeiro de 2015). «Fórum Econômico Mundial discute impacto do câncer». Consultado em 18 de março de 2016
- ↑ a b Thamm, Douglas (março de 2009). «How companion animals contribute to the fight against cancer in humans» (PDF). Veterinaria