Câncer colorretal
| Cancro colorretal | |
|---|---|
| Ilustração do trato digestivo inferior | |
| Especialidade | Oncologia |
| Sintomas | Sangramento gastrointestinal inferior, episódios constantes de diarreia ou prisão de ventre, evacuação dolorosa, gases, afinamento das fezes, desconforto gástrico, sensação de constipação intestinal, sangue nas fezes, grande perda de peso e fadiga constante. [1] |
| Causas | Idade avançada, estilo de vida sedentário e condições genéticas herdadas. [2][3] |
| Fatores de risco | Dieta rica em açúcares e gorduras, obesidade, tabagismo, consumo excessivo de álcool e ausência de exercícios físicos. [2] |
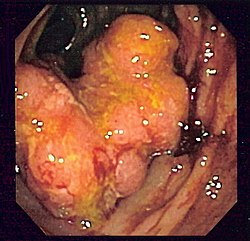
| Método de diagnóstico | Biópsia durante uma sigmoidoscopia ou colonoscopia[1] |
| Prevenção | Rastreio entre os 50 e 75 anos[4] |
| Tratamento | Cirurgia, radioterapia, quimioterapia e terapia dirigida. [5] |
| Prognóstico | Taxa de sobrevivência a 5 anos: 65% (EUA)[6] |
| Frequência | 9,4 milhões (2015)[7] |
| Mortes | 832 000 (2015)[8] |
| Classificação e recursos externos | |
| CID-10 | C18-C20/C21 |
| CID-9 | 153.0-154.1 |
| ICD-O: | M8140/3 (95% cos casos) |
| OMIM | 114500 |
| DiseasesDB | 2975 |
| MedlinePlus | 000262 |
| eMedicine | med/413 med/1994 ped/3037 |
Cancro colorretal (português europeu) ou câncer colorretal (português brasileiro) é o desenvolvimento de cancro no cólon ou no reto, dois segmentos do intestino grosso.[5] A doença tem origem no crescimento anormal de células com a capacidade de invadir ou de se espalhar para outras partes do corpo.[9] Os sinais e sintomas podem incluir sangue nas fezes, alterações nos movimentos intestinais, perda de peso e sensação permanente de fadiga.[1]
A maior parte dos cancros do cólon e do reto devem-se à idade avançada e a fatores de risco relacionados com o estilo de vida. Apenas um pequeno número de casos é que está associado a distúrbios genéticos.[2][3] Entre os fatores de risco estão uma dieta inadequada, obesidade, fumar e ausência de exercício físico.[2][3] Os fatores dietéticos que aumentam o risco incluem o consumo de carne vermelha, carne processada e bebidas alcoólicas.[2] Outro fator de risco é a presença de doenças inflamatórias intestinais, que incluem doença de Crohn e colite ulcerativa.[2] Alguns dos distúrbios genéticos hereditários que causam cancro colorretal incluem polipose adenomatosa familiar e cancro colorretal hereditário sem polipose. No entanto, estes correspondem a apenas 5% dos casos.[2][3] O cancro geralmente tem início com um tumor beningno, muitas vezes na forma de um pólipo, que com o tempo se torna canceroso.[2]
O diagnóstico de cancro colorretal pode ser confirmado pela recolha e de uma amostra do cólon através de sigmoidoscopia ou colonoscopia. Durante uma colonoscopia, geralmente são removidos os pequenos pólipos que forem encontrados. Quando é encontrado um pólipo grande ou um tumor, a biópsia permite confirmar se é canceroso.[1] Posteriormente são realizados exames imagiológicos para determinar se a doença se espalhou.[5] O rastreio é eficaz na prevenção e na diminuição da mortalidade por cancro colorretal.[4] O rastreio de rotina é recomendado dos 50 até aos 75 anos de idade.[4] A aspirina e outros anti-inflamatórios não esteroides diminuem o risco de cancro colorretal.[2][10] No entanto, a sua utilização para este efeito não é recomendada devido aos efeitos adversos.[11]
Os tratamentos para o cancro do cólon e do reto podem incluir alguma combinação de cirurgia, radioterapia, quimioterapia e terapia dirigida.[5] Os cancros que se encontram restritos à parede do cólon podem ser curáveis com cirurgia. No entanto, os cancros que já se espalharam para outras partes do corpo geralmente não são curáveis, focando-se o tratamento na melhoria da qualidade de vida e alívio dos sintomas.[5] A taxa de sobrevivência média a cinco anos nos Estados Unidos é de 65%.[12] No entanto, a sobrevivência depende de quão avançada está a doença, se o cancro pode ou não ser removido com cirurgia e da condição geral de saúde da pessoa.[1] Em todo o mundo, o cancro colorretal é o terceiro tipo mais comum de cancro, correspondendo a cerca de 10% de todos os casos.[13] Em 2012 ocorreram 1,4 milhões de novos casos e 694 000 mortes pela doença.[13] É mais comum em países desenvolvidos, onde ocorrem 65% dos casos.[2] É mais comum em homens do que em mulheres.[2]
Sinais e sintomas
Os sintomas do cancro colorretal dependem da localização do tumor no intestino grosso, do tamanho do tumor em si, e se o tumor tem se espalhado para outras partes do corpo. Os sintomas mais comuns do cancro colorretal são o sangramento intestinal, a mudança do hábito intestinal e da forma das fezes, a dor e distensão abdominais, emagrecimento e anemia. Como estes sintomas, bem como a maioria dos outros sintomas que podem estar presentes com o cancro, são sintomas de outras doenças (como no caso da hemorroida e da doença diverticular), nenhum dos sintomas presentados a seguir são específicos de cancro colorretal, e todos devem procurar auxílio médico para fazer um diagnóstico correto dos sintomas.
Sintomas podem ser locais (presentes na região afetada pelo tumor primário), gerais (afetando o corpo inteiro), ou metastáticos (causados por metástases).
Sintomas locais
Sintomas locais dependem da localização do tumor primário no intestino grosso, sendo mais comuns se o tumor estiver localizado mais próximo ao ânus. Sintomas incluem dor, mudança de hábitos intestinais (tal como diarreia ou obstipação na ausência de outros possíveis agentes causadores), sensação de defecação incompleta, e mudanças no tamanho e formato das fezes (por exemplo, o diâmetro das fezes pode ser menor que o habitual).
Cancros no cólon ascendente e no cecum tendem a crescer de maneira exofítica, ou seja, da parede intestinal para o exterior do intestino grosso. Por causa disso, tais tumores raramente causam obstrução intestinal, com anemia sendo um sintoma muito mais comum. Por outro lado, cancros no lado esquerdo do sistema colorretal tendem a crescer de maneira circular, envolvendo o intestino, e facilmente causando obstrução intestinal.
Hemorragia é um sintoma comum. Presença de sangue nas fezes é um possível indicativo de tumor no sistema digestivo. Se o tumor está presente no reto, um possível sintoma é desconforto na região retal. Se o tumor está localizado no reto ou no cólon descendente, sangue (de cor vermelha clara) e um crescimento da presença de muco nas fezes. Melena, ou seja, fezes de cor escura e cheiro fétido, pode estar presente se o tumor está localizado no cólon transverso ou ascendente.
Se o tumor é grande o suficiente para preencher o lúmen do intestino, o tumor pode causar uma obstrução intestinal. Neste caso, sintomas incluem obstipação, dor abdominal, distensão abdominal e vômito, e pode causar, em casos graves, perfuração gastrointestinal e peritonite.
Certos sintomas do cancro colorretal aparecem quando a doença avança em severidade. Um tumor grande pode ser mais facilmente notado no abdômen, podendo ser notado em um exame físico (por exemplo, palpação). Com o crescimento do tumor, presença de ar ou sangue na urina é possível (quando o tumor invade a bexiga), bem como secreções abnormais na vagina, no caso de invasão do aparelho reprodutor feminino.
Sintomas gerais
Se o tumor tem causado hemorragia crônica oculta, uma possível consequência é anemia ferropriva, devido à perda de ferro como consequência da hemorragia. Sintomas devido à anemia incluem fadiga, palpitações e palidez. Um outro sintoma é falta de apetite, e consequentemente, perda de peso inesperada.
Outros sintomas, mais incomuns, incluem febre de origem desconhecida, e uma das várias síndromes paraneoplásticas, das quais a mais comum é trombose, geralmente trombose venosa profunda.
Sintomas de origem metastática
O órgão mais afetado por metástases do cancro colorretal é o fígado. Este é geralmente afetado em estádio avançado do cancro pelo fato de que a circulação venosa do intestino grosso é feita pela veia porta hepática, e passa pelo fígado. Sintomas de metástases no fígado muitas vezes não causam sintomas notáveis.[14] Grandes depósitos metastáticos no fígado podem causar icterícia, dor abdominal (devido ao esticamento das cápsulas fibrosas de Glisson. Se a metástase bloqueia o ducto biliar, a icterícia pode ser acompanhada por outros sintomas de obstrução biliar, tal como esteatorreia (fezes de cor clara).
Causas
Certos fatores aumentam as chances de uma pessoa ter a doença.[15] Estes fatores incluem:
- Idade: O risco de uma pessoa ter cancro colorretal aumenta com a idade. Ter 50 anos ou mais de idade é um fator em risco em si. Casos antes dos 50 anos são raros, mas podem ocorrer, especialmente se um histórico familiar de desenvolvimento do cancro antes dos 50 existe.[16]
- Hereditariedade:
- Histórico familiar de cancro colorretal: presença de um ou mais parentes de sangue com cancro colorretal, especialmente se o parente é próximo e desenvolveu a doença antes dos 55 anos de idade, ou se múltiplos parentes adquiriram a doença.[17] Cerca de 6% dos cancros colorretais são causados especificamente por problemas genéticos.
- Polipose adenomatosa familiar (FAP): se uma pessoa possui FAP, a chance dele possuir cancro colorretal antes dos 40 anos de idade (se não tratada através de cirurgia) é de quase 100%. Responsável por cerca de 1% dos casos do cancro colorretal.
- cancro colorretal hereditário sem polipose: forma de cancro hereditário, causada por mutações em genes de reparo de DNA. Cerca de 5% dos casos de cancro colorretal podem ser atribuídos a tais mutações.
- A presença de pólipos no intestino grosso é um fator de risco, especialmente se são de natureza adenomatosa. Remover os pólipos presentes no intestino grosso diminui subsequentemente o risco de cancro colorretal.
- Histórico de cancro: indivíduos que já tiveram cancro colorrectal anteriormente estão com risco de desenvolver a doença novamente no futuro. Mulheres que tiveram cancro de ovário, útero ou mama também possuem uma chance maior de ter cancro colorretal.
- Dieta: presentemente, o impacto que a dieta alimentar possui como um fator de risco do cancro colorretal é controverso. Estudos mostram que uma dieta rica em carne vermelha[18] e baixo em frutas frescas, vegetais e legumes, peixes e aves de capoeira aumentam as chances de cancro colorretal. Um estudo da European Prospective Investigation into Cancer and Nutrition, de junho de 2005, sugeriu que dietas ricas em carne vermelha e carnes processadas e baixo em fibra alimentar são associados com maior chance de cancro colorretal. Indivíduos qu comem frequentemente carne de peixe possuem um risco mais baixo.[19] Porém, outros estudos colocam em dúvida sobre o fato que uma dieta baixa em fibras aumente o risco de cancro colorretal, argumentando que tais dietas estão associadas a outros fatores de risco, resultando em erros no estudo.
- Fumo: As pessoas que fumam possuem um risco maior de morrer por causa da doença do que pessoas que não fumam. Um estudo da American Cancer Society concluiu que "mulheres que fumam possuem 40% de chance a mais, do que mulheres que não fumam, de morrer por causa de cancro colorretal, enquanto que o aumento entre homens que fumam é de 30% em relação a homens que nunca fumaram.[20][21]
- Sedentarismo: indivíduos que são fisicamente inativos possuem um risco maior de ter cancro colorretal do que pessoas fisicamente ativas.
- Vírus: alguns vírus (tal como certos tipos do vírus do papiloma humano podem estar associados ao cancro colorretal.
- Colite ulcerosa e Colangite esclerosante primária aumentam o risco de cancro colorretal; o risco do último é independente do primeiro (visto que ambas possuem uma associação significativa).
- Níveis baixos de selênio.[22][23]
- Doença inflamatória intestinal.[24][25] Cerca de 1% dos pacientes com cancro colorretal possuem história de colite ulcerativa crônica. O risco de ter cancro colorretal varia de acordo com a idade em que a colite aparece, diretamente com a extensão de envolvimento no cólon, e a duração da doença em si. Pacientes com doença de Crohn possui um risco um pouco maior de terem cancro colorretal, mas que é menos do que pacientes com colite ulcerativa.[26]
- Fatores ambientais:[24] Habitantes de países industrializados possuem um risco maior de adquirir cancro colorretal do que habitantes de países menos industrializados, nos quais dietas ricas em fibra alimentar e baixo em gordura são mais prevalentes. Estudos de migrações populacionais revelam o impacto que fatores ambientais, especialmente de natureza dietária, possuem na etiologia do cancro colorretal.
- Hormônios exógenos: diferenças em estudos longitudinais entre homens e mulheres e cancro colorretal podem ser explicados por efeitos de coorte em relação à exposição para algum fator de risco (associado especificamente com o sexo). Uma possibilidade é exposição para estrogênios.[27] Isto é válido primariamente para estrogênios exógenos, não produzidos naturalmente pelo corpo, tais como terapia hormonal. Em contrapartida, há pouca evidência que isto é válido para estrogênios endógenos, ou seja, produzidos naturalmente pelo corpo.[28]
- Álcool: possivelmente um fator de risco.[29]
O NIAAA diz que: "Estudos epidemiológicos acharam uma pequena mas consistente associação entre o consumo de álcool (relacionado à quantidade de doses consumidas) e cancro colorretal,[30][31] mesmo quando fatores dietários tais como fibras estão sob controle[32][33] Despite the large number of studies, however, causality cannot be determined from the available data."[29]
Um estudo concluiu que indivíduos que tomam mais de 30 gramas de álcool por dia, e especialmente mais de 45 gramas por dia, possuem uma chance maior de adquirir cancro colorretal".[34][35] Outro concluiu que o consumo diário de bebidas alcoólicas está relacionado com um aumento de 70% na probabilidade de adquirir cancro de cólon[36][37][38]
Outro estudo concluiu que o risco de cancro colorretal é duas vezes maior em indivíduos que consomem constantemente cervejas e espíritos, embora seja menor em pessoas que tomam vinho.[39]
Outros estudos sugerem que moderação é um modo de minimizar o risco de adquirir cancro colorretal,[29] e que o consumo de bebidas alcoólicas podem causar precipitar o desenvolvimento mais cedo de cancro colorretal.[40]
O Instituto de cancro Nacional americano não lista álcool como um fator de risco,[41] porém, em outra página, sugere que o "consumo frequente de bebidas alcoólicas pode aumentar o risco de cancro colorretal"[42]
Fisiopatologia
Em 85% dos casos, o cancro colorretal é precedido por uma lesão benigna conhecida por pólipo. Dependendo da característica deste pólipo, ele pode se tornar maligno e iniciar o cancro. Devido a este processo é que se faz a prevenção deste tipo de tumor com a colonoscopia, já que este exame permite o diagnóstico e a retirada do pólipo. Nos outros 15% dos casos, o tumor ocorre devido a uma doença genética, e se caracteriza por acometer pacientes mais jovens e por não apresentar o pólipo como lesão pré-maligna, ou seja, surge diretamente na parede do intestino.
Em aproximadamente 25% dos casos de cancro colorretal, o tumor está presente no reto, e 24%, no cólon sigmóide, ou seja, em metade dos casos, o tumor está localizado na região retosigmóide do intestino grosso, e pode ser visualizado por um sigmoidoscópio. Em outros 20% dos casos, o tumor pode ser detectado através de um exame retal. Em outras partes do cólon, as taxas são cerca de 6% no cólon descendente, 11% no cólon transverso, 24% no cólon ascendente, e 10% no cecum.
O cancro colorretal é uma doença que se origina nas células epiteliais que envolvem o aparelho digestivo. Doenças hereditárias ou mutações somáticas em certas sequências de DNA, entre os quais, genes de replicação do DNA e genes do reparamento de DNA,[43] bem como nos genes APC, Ras, NOD2 e p53,[44] podem levar à divisão celular abnormal.
Diagnóstico
O cancro colorretal pode tomar muitos anos para desenvolver-se, e detecção do cancro nos estádios iniciais aumenta significantemente as chances de cura. O National Cancer Policy Board do Instituto de Medicina americano, estimou em 2003 que até modestos esforços para implementar métodos de detecção do cancro colorretal causaria uma queda de 29% em mortes de cancro em 20 anos. Porém, a taxa de indivíduos utilizando métodos de detecção precoce permanecem baixas.[45]
Vários tipos de testes podem ser utilizados para detecção do cancro colorretal:
- Exame retal: o médico, utilizando luvas e lubrificante, coloca o dedo dentro do reto do paciente, buscando por áreas anormais. Este teste não deve ser utilizado como método único de detecção - uma vez que somente cerca de 20% dos tumores colorretais estão ao alcance do dedo, e somente tumores grandes o suficiente podem ser sentidos através desta técnica - mas pode ser utilizado como um método inicial de detecção, sempre em conjunto com outros métodos.
- Exame de sangue oculto nas fezes: teste que verifica a presença de sangue nas fezes. Dois tipos de testes podem ser utilizados para detectar sangue oculto nas fezes: químico ou imunoquímico. A sensitividade do teste imunoquímico é superior ao teste químico, sem causar uma redução inaceitável em especificidade.[46]
- Endoscopia:
- Sigmoidoscopia: uma sonda iluminada (o sigmoidoscópio) é inserida no reto e no cólon inferior, para detectar pólipos e outras abnormalidades.
- Colonoscopia: Uma sonda iluminada (o colonoscópio) é inserida no reto e em todo o cólon, para detectar pólipos e outras abnormalidades. Vantagens em relação à sigmoidoscopia é que se pólipos são encontrados, eles podem ser removidos, tecido pode ser removido (biópsia), além de abranger todo o cólon, e não somente a parte inferior.
Outros métodos de detecção
- Enema de bário com duplo contraste: com o cólon livre de material fecal, um enema contendo sulfato de bário é administrado, e então ar é inserido dentro do cólon, distendendo-no. O resultado é uma faixa fina de bário cobrindo todo o interior do cólon, que é visível em raios-X. Tumores ou pólipos podem ser detectados através deste método. Esta técnica pode não detectar pólipos planos (não muito comuns).
- Colonoscopia virtual substitui filmes de raios-X no enema de bário com duplo contraste (acima) com um exame especial de tomografia computadorizada, que requer software apropriado para permitir a interpretação por um radiologista. Esta técnica está alcançando a colonoscopia em sensitividade na detecção de pólipos. Porém, quaisquer pólipos que são encontrados ainda precisam ser removidos via uma colonoscopia padrão.
- Tomografia computadorizada axial é um método que utiliza raios-X que pode ser utilizado para determinar o grau de espalhamento do cancro, mas não é sensitivo o suficiente para ser utilizado como método de detecção precoce. Certos tipos de cancro são encontrados em exames tomográficos realizados por outras razões.
- Exames de sangue: o nível de certas proteínas no sangue pode ser um indicativo da severidade do tumor - em especial, antígene carcinoembriônico. Porém, um resultado negativo não significa necessariamente ausência de malignidade, e um resultado positivo (sujeitos, portanto a falsos positivos e falsos negativos), cancro colorretal especificamente, e portanto, não devem ser utilizados como método de detecção precoce. Altos níveis do antígene carcinoembriônico podem significar metástases ou outros tipos de cancro. Porém, tais exames podem ser ser usados para monitorizar o paciente após cirurgia ou outro tratamento.
- Aconselhamento genético e exame genético podem ser utilizados em famílias que possuem uma forma hereditária do cancro colorretal, tal como cancro colorretal hereditário sem polipose, ou polipose familiar adenomatoso.
- Tomografia por emissão de positrões (PET) é uma técnica no qual um açúcar radioativo é injetado no paciente; tal açúcar acumula-se em tecidos com alta atividade metabólica (incluindo células cancerosas), a radiação emitida pelo açúcar permite a formação de uma imagem. Por causa do fato que células cancerígenas possuem um alto metabolismo, esta técnica pode ser utilizada para diferenciar tumores benignos e malignos. Porém, esta técnica não é utilizada como método de detecção precoce. Um exame de PET do corpo inteiro é considerado o método mais preciso de cancro colorretal recorrente, e é uma maneira custo-efetiva de diferenciar tumores que podem ser cirurgicamente removidos dos que não podem. Este exame é indicado quando uma decisão depende de um preciso estudo da presença do tumor e da sua extensão.
- Exame de DNA nas fezes é uma tecnologia emergente utilizado para detectar cancro colorretal. Adenomas pré-malignos e células cancerígenas liberam marcadores de DNA que não são decompostos no processo digestivo, e permanecem intactos nas fezes. PCR aumenta a concentração de DNA para níveis detectáveis. Ensaios clínicos têm mostrado uma sensitividade de detecção de cancro de 71% a 91%.[47]
Classificação
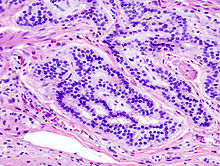
O tipo do tumor é geralmente diagnosticado através da análise de tecido removido através de uma biópsia ou cirurgia. O diagnóstico patológico geralmente contém a descrição histológica do cancro, e o grau. O tipo mais comum de cancro colorretal é adenocarcinoma, que compõe 95% dos casos - acredita-se que a maioria dos casos de cancro colorretal envolvam tumores originários de pólipos adematosos. Outros tipos, mais raros, de cancro colorretal, incluem linfoma e carcinoma espinocelular. As causas do cancro colorretal não são conhecidas com exatidão no presente.
Adenocarcinoma é um tipo de tumor maligno epitelial, que se origina do epitélio glandular da mucosa colorretal. Tal tumor invade a parede, infiltrando a mucosa muscular, a submucosa, e daí, a muscularis propria. As células do tumor abrigam estruturas tubulares irregulares, de estrutura pluristratificada, lúmens múltiplos, e estromas reduzidos. Por vezes, as células do tumor secretam muco, que invade o fluido intersticial, produzindo grandes agrupamentos de muco e colóide (que, visualmente, aparecem como "espaços vazios") - é o chamado adenocarcinoma colóide, pouco diferenciado. Se o muco permanece dentro da célula do tumor, o muco empurra o núcleo celular para a periferia da célula - célula do tipo signet-ring. Dependendo da arquitetura glaudular, pleomorfismo celular, e padrão da secreção de muco, o adenocarcinoma pode ser categorizado em três graus de diferenciação: bem diferenciado, moderadamente diferenciado, e mal diferenciado.[48]
Acredita-se que a maioria dos tumores do cancro colorretal sejam positivos a COX-2. Esta enzima geralmente não é encontrada em tecido saudável do cólon. Acredita-se que tal enzima alimenta crescimento celular anormal.
Estadiamento
| Estádio (AJCC) | Estádio (TNM) | Critério TNM de cancro colorretal[49] |
|---|---|---|
| Estádio 0 | Tis N0 M0 | Tis: Tumor confinado na mucosa; ou seja, carcinoma in situ |
| Estádio I | T1 N0 M0 | T1: Tumor invade a submucosa |
| Estádio I | T2 N0 M0 | T2: Tumor invade a muscularis propria |
| Estádio II-A | T3 N0 M0 | T3: Tumor invade a subserosa, ou além (sem envolver outros órgãos) |
| Estádio II-B | T4 N0 M0 | T4: Tumor invade órgãos adjacentes, ou perfura o peritôneo |
| Estádio III-A | T1-2 N1 M0 | N1: Metástase para um a três nódulos linfáticos. T1 ou T2. |
| Estádio III-B | T3-4 N1 M0 | N1: Metástase para um a três nódulos linfáticos. T3 ou T4. |
| Estádio III-C | qualquer T, N2 M0 | N2: Metástases para quatro ou mais nódulos regionais. Qualquer T. |
| Estádio IV | qualquer T, qualquer N, M1 | M1: Metástases distantes presentes. Qualquer T, qualquer N. |
O estadiamento de cancro colorretal é uma estimativa da extensão de penetração de um cancro em particular. É feito por razões de diagnose e pesquisa, e para determinar o melhor método de tratamento. Os sistemas para avaliar cancros colorretais dependem da extensão da invasão local, o degrau de invasão de nódulos linfáticos, e da presença de metástases distantes.
Estadiamento definitivo pode ser somente feito após colectomia. Uma exceção para este princípio seria após uma polictomia colonoscópica de um pólipo pdunculado maligno, com mínima invasão. Estadiamento pré-operacional de cancros do reto pode ser feito com ultra-som endoscópico. Estadiamento adjunto de metástases inclui ultrassom abdominal, CT, PET, e outros estudos de imagem.
O sistema de estadiamento mais comum é a classificação TNM (para tumores, nódulos e metástases), desenvolvida pela American Joint Committee on Cancer (AJCC). O sistema TNM possui três categorias, cada uma com números indicando a severidade da extensão do tumor. "T" denota o degrau de invasão da parede intestinal, "N" o degrau de involvimento de nódulos linfáticos, e "M" a presença de metástases. Estádios são geralmente descritos em numerais romanos (I, II, III, IV). Um número maior indica cancro mais avançado, e pior prognóstico.
Classificação Dukes
A classificação Dukes é um sistema de estagiamento mais antigo e menos complicado que a classificação TNM, tendo sido proposto pelo Dr. Cuthbert Dukes em 1932. Os seguintes estágios são usados:[14]
- A: Tumor confinado na mucosa da parede intestinal.
- B1: Tumor expandindo-se dentro da mucosa, mas não além.
- B2: Tumor expande-se para outras regiões da parede intestinal, mas não além.
- C1: Tumor invade nódulos linfáticos, nódulo linfático ápico não invadido.
- C2: Tumor invade nódulos linfáticos, nódulo linfático ápico invadido.
- D: Presença de metástases distantes.
Alguns centros de tratamento de cancro ainda utilizam este sistema.
Prevenção
Acredita-se que a maioria dos cancros colorretais podem ser prevenidos, através do uso de métodos de deteção, da manutenção de um saudável estilo de vida, e provavelmente, do uso de agentes dietários quimiopreventivos.
Detecção
A maioria dos tumores colorretais surgem de pólipos adenomatosos. Tais pólipos podem ser detectados e removidos através de colonospia. Este método é considerado presentamente o padrão-ouro de detecção do cancro colorretal.
Estudos mostram que o uso frequente deste procedimento médico poderia diminuir em 80% o número de mortes causados pelo cancro, desde que tais testes comecem na idade de 50 anos, e repetidos a cada cinco a dez anos.[50]
Para indivíduos sem sintomas, sem fatores de risco, mas com 50 anos de idade ou mais, um exame de sangue oculto nas fezes ou contraste duplo de enema de bário anual, e sigmoidoscopia cada cinco anos, a partir dos 50 anos, podem ser utilizados em conjunto ao invés de colonoscopia, como método de detecção. Sigmoidoscopia mais contraste duplo em conjunto é utilizado também quando acredita-se que um indivídui possa ter cancro colorretal, e abnormalidades embora o padrão-ouro de detecção seja colonoscopia, que, se não utilizado como o principal método de detecção do cancro colorretal, é utilizado se abnormalidades são encontradas nos exames acima.
Estilo de vida e nutrição
A análise da incidência do cancro colorretal em vários países sugere que sedentarismo, comer em excesso (por exemplo, dieta alta em calorias), e possivelmente, uma dieta rica em carne vermelha ou processada pode aumentar o risco de cancro colorretal. Em contraste, um peso dentro de padrões considerado saudáveis, atividade física, e uma dieta saudável, diminui o risco de cancro, em geral. Mudanças no estilo de vida podem diminuir o risco de cancro colorretal em 60% a 80%.[51]
Até recentemente, acreditava-se que uma dieta rica em fibra alimentar (frutas, cereais, vegetais) reduzisse o risco de cancro colorretal e adenoma. O maior estudo já realizado para examinar esta teoria (envolvendo 88 757 participantes ao longo de 16 anos), porém, demonstrou que uma dieta rica em fibra alimentar não reduz o risco de cancro colorretal.[52] Uma metanálise suporta esta conclusão.[53]
Quimioprevenção
Acredita-se que cerca de 200 agentes, incluindo aspirina e componentes nutricionais tais como cálcio e ácido fólico, podem diminuir carcninogênese, segundo modelos de desenvolvimento pré-clínico. Alguns estudos mostram inibição de tumores induzidos por carcinógenos no cólon de ratos. Outros estudos mostram uma forte inibição no pólipos intestinais de ratos (geneticamente criados para terem tais pólipos). Ensaios clínicos em humanos mostram um efeito reduzido, mas poucos estudos de intervenção envolvendo tais agentes foram realizados presentemente.[54]
Uma metanálise concluiu que a ingestão diária de 300 mg ou mais durante cinco anos é efetivo na prevenção do cancro colorretal em provas controladas aleatórias, com uma latência de cerca de dez anos.[55] Porém, aspirina não deve ser tomada routineiramente com o intuito de prevenir cancro colorretal, mesmo em pessoas com histórico familiar, por causa do risco de hemorragia e insuficiência renal se uma alta dose de aspirina é ingerida constantemente (300 mg ou mais, com maior risco de hemorragia se mais de 81 mg o dia de aspirina é ingerido[56]), com potenciais problemas à saúde de maior peso do que o possível benefício.[57] Uma recomendação de prática clínica da U.S. Preventive Services Task Force (USPSTF) é contra o uso da aspirina, argumentando que embora a aspirina possa diminuir o risco de ter cancro do cólon, que os "riscos são maiores que benefícios".
Uma metanálise da Colaboração Cochrane de 2002 concluiu que, embora haja evidência que suplementos de cálcio podem prevenir moderadament pólipos colorretais adenomatosos, tal evidência não é suficiente para recomendar o uso geral de suplementos de cálcio com o intuito de prevenir cancro colorretal.[58] Subsequentemente, uma prova controlada aleatória da Women's Health Initiative obteve resultados negativos.[59] Uma outra prova controlada aleatória anunciou redução em todos os tipos de cancros, mas tinha um número insuficiente de casos envolvendo cancro colorretal para análise.[60]
Tratamento
O tratamento depende do estagiamento do cancro. O índice de cura de cancro diagnosticado nos estádios iniciais é significantemente maior do que quando detectado em estádio avançado (quando metástases distantes estão presentes).
Cirurgia é atualmente o principal método de tratamento curativo do cancro colorretal, enquanto que quimioterapia e/ou radioterapia podem ser recomendados, dependendo do estagiamento do cancro e de outros fatores médicos.
Tratamento agressivo de cancro colorretal é muitas vezes um desafio (especialmente após cirurgia), uma vez que a maioria dos pacientes afetados são pessoas mais velhas. Estudos sugerem que tratamento em idosos em boas condições físicas é mais bem-sucedido se quimioterapia adjuvante é utilizado após cirurgia. Por causa disso, idade cronológica não deve ser uma contraindicação para tratamento agressivo, por si só.[61]
Antígeno carcinoembriônico é uma proteína presente no sangue em virtualmente todos os tumores colorretais (bem como outros tipos de cancros). A análise dos níveis desta proteína com o tempo, pré e pós-cirurgia, permite monitorar o tratamento do cancro. Altos níveis desta proteína, ou a ausência de uma queda notável no nível desta proteína, pós-cirurgia, são um indicativo de tumor residual ou metástases. Diminuição do nível do antígeno é um indicativo de que o tumor foi removido com relativo sucesso. Um aumento nos níveis do antígeno pós-cirurgia é indicativo de recorrência.
Prognóstico
As chances do tratamento ser eficiente dependem do estádio do cancro. No geral, 90% dos pacientes que são diagnosticados com cancro em estádios iniciais sobrevivem cinco anos, caindo para 64% se o tumor invadiu nódulos linfáticos e/ou órgãos próximos.[14] Quando o cancro é diagnosticado em estádio avançado, com metástases distantes, a taxa de sobrevivência de cinco anos é de 20%.
Cirurgia
Presentemente, cirurgia é o único tratamento curativo usado no tratamento do cancro colorretal.
Cirurgias podem ser categorizadas em curativo, paliativo, ou de bypass.
Em cirurgias de caráter curativo, a parte afetada do órgão é removida. Anastomose pode ou não ser possível, dependendo da severidade e da localização do tumor. Se anastomose não é possível, a porção distal do aparelho colorretal é removida.
Cirurgias de caráter curativo são oferecidos quando:
- cancro em estádios bem iniciais que se desenvolvem dentro de um pólipo podem ser tratados com a remoção do pólipo (através de uma polictemia) em uma colonoscopia.
- Um tumor mais avançado tipicamente requer a remoção cirúrgica da secção afetada pelo tumor, bem como tecido aparentemente saudável em torno do tumor (margem de segurança), além da amputação radical do mesentério e nódulos linfáticos locais, para reduzir recorrência local. Se possível, as partes restantes do cólon são ligadas através de uma anastomose, para criar um cólon funcional. Se anamostose não é possível, toda a parte afetada do cólon, bem como a região distal do aparelho colorretal, é removida, e uma ostomia (um orifício artificial) é criada, via colostomia. Ou seja, mais cólon é removido à medida que a região afetada é mais próxima ao intestino delgado. Por vezes, a região saudável distal do cólon é mantida e suturada (Cirurgia de Hartmann), quando a parte afetada está localizada na região reto-sigmóide do cólon; neste caso, futura anastomose por emissão de positrões é possível.[14]
- Cirurgia de caráter curativo no cancro retal inclui ou amputação parcial da parte anterior inferior do reto, ou uma amputação abdominoperineal. Dependendo da severidade do cancro, os médicos podem optar por remover apenas a parte afetada, em uma amputação parcial. o restante do reto pode ser conectado com o restante do cólon via anastomose. Se o restante saudável do reto não é suficiente para garantir uma anastomose segura e/ou funcionamento do esfincter anal, ou se o tumor está próximo ao ânus (dois a cinco centímetros), amputação parcial do reto não é possível, e todo o reto mais a região proximal do cólon sigmóide é amputado via amputação abdominoperineal, e uma colostomia de caráter permanente é realizada.
Se metástases existem, cirurgia de caráter curativo não é uma opção (por ser considerado fútil), no geral. Porém, cirurgia de caráter paliativo pode ser realizada, com o intuito de deixar o paciente mais confortável: a remoção de parte ou todo tumor primário tem o intuito de reduzir a morbidade causada por hemorragia (causado pelo tumor), invasão, e seu efeito catabólico. Porém, no caso de metástases isoladas no fígado, cirurgias de caráter curativo pode ainda ser realizadas, sendo relativamente comuns. Avanços na quimioterapia têm aumentado o número de pacientes que recebem a opção de remover cirurgicamente metástases isoladas no fígado.
Se o tumor invadiu estruturas vitais (tornando excisão cirúrgica tecnicamente difícil), cirurgiões podem optar por não remover o tumor, e ao invés disso, criar uma nova passagem para a passagem de fezes, e removendo a parte afetada da parte do restante do sistema digestivo do paciente (mas não removendo tal parte), em uma cirurgia de bypass; ou através de uma diversão fecal (colostomia). O intuito de ambos os tipos de cirurgia é comumente paliativo, embora cirurgia de caráter curativo possa ser realizada caso o tumor responda a quimioterapia.
Um último tipo de cirurgia é o "abre-e-fecha", de caráter não-intencional: tal cirurgia acontece quando os cirurgiões descobrem que o tumor não pode ser removido, e quando o intestino delgado foi invadido pelo tumor; neste caso, a continuação da cirurgia causará mais problemas do que benefícios para o paciente. Este tipo de cirurgia é cada vez mais incomum devido à laparoscopia e avanços radiológicos. Casos anteriormente vulneráveis ao "abre-e-fecha" atualmente são frequentemente diagnosticados em avanço, e cirurgia é evitada.
Coloctemia assistida por laparoscopia é um procedimento pouco invasivo que pode reduzir o tamanho da incisão e dor pós-operacional.
Como qualquer procedimento cirúrgico, cirurgia coloretal pode resultar em complicações, tais como:
- Infecção nas regiões diretamente afetadas pela cirurgia.
- Hérnia intestinal, e/ou deincência.
- Hemorragia, com ou sem formação de hematoma.
- Quebra da anastomose, levando a abscesso, formação de fístula, e/ou peritonite.
- Adesões, resultando em obstrução intestinal. Em um estudo de cinco anos, com pacientes que tiveram cirurgia em 1997, 15% dos pacientes foram readmitidos após panproctocolectemia, 9% após colectemia total, e 11% após ileostomia.[62]
- Lesões a órgãos adjacentes, mais comumente, para o intestino delgado, uretras, baço e/ou bexiga.
- Complicações cardio-respiratórias, tais como infarto do miocárdio, pneumonia, arritmias, embolismo pulmonar, etc.
Quimioterapia
Quimioterapia é utilizada para reduzir o risco de metástases, para reduzir o tamanho do tumor, e/ou reduzir o crescimento do tumor. Quimioterapia é comumente utilizada após cirurgia, como método de tratamento adjuvante, antes de cirurgia, como método de tratamento neo-adjuvante, ou como o principal método de tratamento, em paliação. O uso de tratamentos mostrados aqui tem resultado, em ensaios clínicos, em uma diminuição da taxa de mortalidade, e como resultado, esses tratamentos foram aprovados para uso pela FDA (nos Estados Unidos). Em geral, quimioterapia é somente utilizada após cirurgia se o tumor espalhou-se para nódulos linfáticos (estádio III).
Em 2008, pesquisadores anunciaram, em um encontro anual da American Society of Clinical Oncology (ASCO, Sociedade de Clínica Oncológica Americana), que pacientes com cancro colorretal que possuem uma mutação no gene KRAS não respondem a certas drogas quimioterapêuticas, mais especificamente, àquelas que inibem o receptores de fator de crescimento epidermal nas células cancerosas (EGFR, de epidermal growth factor receptor) - tais como Erbitux (cetuximab) e Vectibix (panitumumab).[63] Após recomendações da ASCO, pacientes devem agora ser testado pela mutação no gene KRAS (nos Estados Unidos), antes de puderem utilizar tais drogas inibidoras do EGFR.[64] Em 2009, a FDA nos Estados Unidos obrigou que as embalagens de duas drogas antiEGFR anticorpo monoclonal (panitumumab e cetuximab), indicados para o tratamento de cancro metastático colorretal, para incluir informação sobre tais mutações do KRAS.[65]
Porém, mesmo que o gene KRAS seja normal, não há nenhuma garantia que tais drogas irão beneficiar o paciente.[63] Nestes pacientes, drogas antiEGFR reduzem o tamanho dos tumores em cerca de 40% dos pacientes. Estudos mostram que cerca de 35% a 46% dos pacientes possuem mutações no gene KRAS. O custo-benefício de testar pacientes para verificar por mutações no gene KRAS, poderia salvar cerca de 740 a 750 milhões de dólares (nos Estados Unidos) para pacientes, que não iriam beneficiar das drogas.[66]
- Quimioterapia como tratamento adjuvante (após cirurgia): um regime comumente usado envolve a combinação das três seguintes drogas:
- 5-fluorouracil (5-FU)
- Leucovirina (LV, ácido folínico)
- Oxaliplatina (Eloxatin)
- Quimioterapia em cancros metastáticos: regimes comumente usados envolvem a combinação de 5-fluorouracil, leucovorina e oxaliplatina com bevacizumab; ou 5-fluorouracil, leucovorina e irinotecan com bevacizumab.
- 5-fluorouracil (5-FU)
- Leucovirina (LV, ácido folínico)
- Oxaliplatina (Eloxatin)
- Tegafur-uracil (UFT)
- Irinotecan (Camptosar)
- Oxaliplatin (Eloxatin)
- Bevacizumab (Avastin)
- Cetuximab (Erbitux)
- Panitumumab (Vectibix)
- Em ensaios clínicos para cancro colorretal avançado (metástases distantes):
- Bortezomib (Velcade)
- Oblimersen (Genasense, G3139)
- Gefitinib e Erlotinib (Tarceva)
- Topotecan (Hycamtina)
Radioterapia
Radioterapia não é utilizada frequentemente no tratamento do cancro colorretal, porque pode causar enterite radioativa, bem pelo fato de que mirar partes específicas do cólon é difícil (por causa de peristalse). Radioterapia é mais utilizada em cancro do reto, já que o reto não se movimenta tanto como o cólon, e por isso, é mais fácil de mirar. Às vezes, agentes quimioterapêuticos são utilizados para aumentar a eficiência da radiação, através do aumento da sensitividade em células do tumor, se presentes. Indicações para o uso de radioterapia incluem:
- Paliação e redução de dor em cancro do cólon avançado. Neste caso, não utilizado no tumor primário, mas sim em depósitos de metástases, se eles comprimem estruturas vitais e/ou causam dor.
- Em cancro do reto:
- Neo-adjuvante: utilizado antes de cirurgia em pacientes com tumores que se estendem além do reto ou invadiram nódulos linfáticos regionais, para diminuir o risco de recorrência após cirurgia ou para permitir uma cirurgia de caráter menos invasivo.
- Adjuvante: quando o tumor perfura o reto ou invade nódulos linfáticos regionais (T3 ou T4, classificação AJCC, ou B ou C na classificação Duke).
- Paliativo: para diminuir ou prevenir sintomas.
Tratamento de metástases no fígado
Mais de 20% dos pacientes diagnosticados com cancro colorretal possuem metástases (estádio IV) colorretal no momento do diagnóstico, e deste grupo, cerca de 25% possuem metástases isoladas no fígado que podem potencialmente ser removidas por cirurgia. A remoção de tais metástases através de cirurgia curativa presentemente possui probabilidade de sobrevivência de cinco anos de mais de 50%.[67] Médicos determinam se uma metástase do fígado é removível usando tomografia computadorizada ou ressonância magnética pré-cirurgia, mais ultrassom intraoperativo, e através de palpação direta e visualização durante a removimento. Lesões confinadas no lobo direito do fígado podem ser removidas en bloc com uma hepatetomia do lado direito do fígado. Lesões menores na parte central ou esquerdo do fígado podem às vezes ser removidas em "segmentos"anatômicos", enquanto lesões consideráveis no lobo esquerdo são removidas através de uma trisegmentotomia hepática. Tratamento de lesões através de remoção não-anatômicas menores é associado com maior taxa de recorrência. Lesões não inicialmente consideradas aptas à remoção via cirurgia curativa podem ser consideradas posteriormente caso respondam à quimioterapia. Lesões não consideradas aptas à remoção também podem ser tratadas através de ablação de rádio-frequência, crioablação e embolização química.
Pacientes com cancro colorretal e metástases no fígado podem ser tratados em uma única cirurgia, ou em múltiplas cirurgias (neste caso, o tumor no cólon é tradicionalmente removido primeiro), dependendo da condição do paciente para cirurgia prolongada, a dificuldade dos procedimentos cirúgicos envolvidos, e se o cirurgião está disposto a fazer uma cirurgia hepática (potencialmente complexa) em conjunto com a remoção do tumor primário.
Imunoterapia
Presentemente, o Bacillus Calmette-Guérin (BCG) está sendo investigado como um método adjuvante, em células cancerígenas autólogas, como tratamento imunoterapêutico para o cancro colorretal.[68]
Vacina
Em novembro de 2006, pesquisadores anunciaram que uma vacina para o tratamento do cancro colorretal foi desenvolvida e testada em ensaios clínicos com resultados bastante promissores.[69] A nova vacina, chamada de TroVax, estimula o sistema imunológico do indivíduo a enfrentar as células cancerígenas. Especialistas acreditam que vacinas baseadas em terapia genética poderão provar ser um eficiente método de tratamento no futuro, para vários tipos de cancros. Ensaios clínicos fase III estão sendo realizados para pacientes com cancro renal, e planejado para pacientes com cancro do cólon.[70]
Terapias de suporte
Como outros tipos de cancro, o diagnóstico de cancro colorretal frequentemente resulta em uma mudança enorme no bem-estar psicológico do paciente. Vários tipos de suporte psicológico são frequentemente oferecidos em hospitais, como aconselhamento, serviços sociais, suportes em grupo de cancro, entre outros. Tais serviços ajudam a mitigar algumas das dificuldades em integrar as complicações médicas causadas pelo cancro em outros aspectos da vida do paciente.[71]
Aspirina
Um estudo em 2009 mostrou que aspirina reduz o risco de neoplasia colorretal em provas aleatórias, e inibe crescimento do tumor e metástases em animais. Porém, a influência da aspirina nas taxas de sobrevivência pós-diagnóstico do cancro colorretal é desconhecida..[72]
Acompanhamento
O objetivo do monitoramento pós-tratamento (ou follow-up) é diagnosticar o mais rápido possível quaisquer metástases ou tumores que desenvolveram-se posteriormente, mas não se originaram do tumor original. A ASCO e o National Comprehensive Cancer Network dão as seguintes recomendações para o follow-up do cancro colorretal.[73][74] Uma história médica em conjunto com uma examinação física são recomendadas a cada três a seis meses, por dois anos, e após, a cada seis meses, por cinco anos. Exame de nível de antígeno carcinoembriônico no sangue segue o mesmo padrão de tempo, mas é somente aconselhável em pacientes com T2 ou lesões mais severas, e que são candidatos a cirurgia curativa. Tomografia computadorizada do peito, abdômen e do pélvis pode ser considerado anualmente nos primeiros três anos para pacientes com alta chance de recorrência (por exemplo, pacientes com tumores pouco diferenciáveis ou invasão venosa e/ou linfática), pós-cirurgia. Uma colonoscopia pode ser realizada após um ano, exceto se este procedimento não pôde ser realizado como método de estagiamento; neste caso, uma colonoscopia deve ser realizada três a seis meses após a cirurgia. Se um pólipo viloso, pólipo com mais de um centímetro, ou uma displasia de alto grau são encontrados, a colonoscopia pode ser repetida após três anos, e então, a cada cinco anos. Para qualquer outra abnormalidade, a colonoscopia pode ser repetida após um ano.
Tomografia por emissão de positrões, ultrassom, raios-X, um exame completo de sangue ou exames de fígado periódicos não são recomendados.[73][74] Esta recomendação é baseada em metanálises recentes mostrando que vigiamento intensivo e monitoramento pós-tratamento pode reduzir a mortalidade de cinco anos de 37% para 30%.[75][76][77]
Epidemiologia
Em Portugal, a taxa de mortalidade é de 1,8 para cada 100 mil homens, e 2,5 para mulheres, semelhante à de outros países da União Europeia.[78] No Brasil, estima-se que cerca de 27 mil pessoas foram diagnosticadas com cancro colorretal em 2008, com mulheres sendo mais afetadas do que homens (12,5 mil homens e 14,5 mil mulheres)[79]
Nos Estados Unidos e no Canadá, o cancro colorretal atinge mais homens do que mulheres[80] (10,5 mil homens e 9 mil mulheres, no Canadá, em 2005, com 8,4 mil mortes no mesmo ano).[14] O risco de uma pessoa ter cancro colorretal na vida é de 7% nos EUA. Estima-se que cerca de 150 mil americanos são diagnosticados todo ano, causando aproximadamente 50 mil mortes.
O cancro colorretal é o terceiro cancro mais comum no mundo ocidental, atrás apenas do cancro de pulmão e do cancro de mama (não incluindo carcinomas basocelulares e espinocelulares), e o segundo em número de mortes (atrás do cancro de pulmão). Nos países desenvolvidos, a mortalidade cinco anos após diagnóstico varia entre 30% a 40%.
Ver também
Referências
- ↑ a b c d e «General Information About Colon Cancer». NCI. 12 de maio de 2014. Consultado em 29 de junho de 2014
- ↑ a b c d e f g h i j k World Cancer Report 2014. [S.l.]: World Health Organization. 2014. pp. Chapter 5.5. ISBN 9283204298
- ↑ a b c d «Colorectal Cancer Prevention (PDQ®)». National Cancer Institute. 27 de fevereiro de 2014. Consultado em 29 de junho de 2014
- ↑ a b c Bibbins-Domingo, Kirsten; Grossman, David C.; Curry, Susan J.; Davidson, Karina W.; Epling, John W.; García, Francisco A. R.; Gillman, Matthew W.; Harper, Diane M.; Kemper, Alex R.; Krist, Alex H.; Kurth, Ann E.; Landefeld, C. Seth; Mangione, Carol M.; Owens, Douglas K.; Phillips, William R.; Phipps, Maureen G.; Pignone, Michael P.; Siu, Albert L. (21 de junho de 2016). «Screening for Colorectal Cancer». JAMA. 315 (23). 2564 páginas. doi:10.1001/jama.2016.5989
- ↑ a b c d e «Colon Cancer Treatment (PDQ®)». NCI. 12 de maio de 2014. Consultado em 29 de junho de 2014
- ↑ «SEER Stat Fact Sheets: Colon and Rectum Cancer». NCI. Consultado em 18 de junho de 2014. Cópia arquivada em 24 de junho de 2014
- ↑ GBD 2015 Disease and Injury Incidence and Prevalence, Collaborators. (8 de outubro de 2016). «Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990–2015: a systematic analysis for the Global Burden of Disease Study 2015.». Lancet. 388 (10053): 1545–1602. PMC 5055577
 . PMID 27733282. doi:10.1016/S0140-6736(16)31678-6
. PMID 27733282. doi:10.1016/S0140-6736(16)31678-6 - ↑ GBD 2015 Mortality and Causes of Death, Collaborators. (8 de outubro de 2016). «Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980–2015: a systematic analysis for the Global Burden of Disease Study 2015.». Lancet. 388 (10053): 1459–1544. PMC 5388903
 . PMID 27733281. doi:10.1016/s0140-6736(16)31012-1
. PMID 27733281. doi:10.1016/s0140-6736(16)31012-1 - ↑ «Defining Cancer». National Cancer Institute. Consultado em 10 de junho de 2014
- ↑ Thorat, MA; Cuzick, J (dezembro de 2013). «Role of aspirin in cancer prevention.». Current Oncology Reports. 15 (6): 533–40. PMID 24114189. doi:10.1007/s11912-013-0351-3
- ↑ «Routine aspirin or nonsteroidal anti-inflammatory drugs for the primary prevention of colorectal cancer: recommendation statement.». American Family Physician. 76 (1): 109–13. 2007. PMID 17668849
- ↑ «SEER Stat Fact Sheets: Colon and Rectum Cancer». NCI. Consultado em 18 de junho de 2014
- ↑ a b World Cancer Report 2014. [S.l.]: World Health Organization. 2014. pp. Chapter 1.1. ISBN 9283204298
- ↑ a b c d e Lewis, Sharon Mantik (2006). Medical-Surgical Nursing in Canada. [S.l.]: Elsevier. ISBN 9780779699698
- ↑ Levin KE, Dozois RR. Department of Surgery, Mayo Clinic, Rochester, Minnesota 55905 Epidemiology of large bowel cancer. World J Surg. 1991 Sep-Oct;15(5):562-7. PMID 1949852.
- ↑ «Penn State University» health and disease information
- ↑ «Hereditary colorectal cancer syndromes» at pubmed
- ↑ Chao A, Thun MJ, Connell CJ, McCullough ML, Jacobs EJ, Flanders WD, Rodriguez C, Sinha R, Calle EE. Meat consumption and risk of colorectal cancer. JAMA 2005;293:172-82. PMID 15644544.
- ↑ BBC News (15 de julho de 2005). «Red meat 'linked to cancer risk»
- ↑ American Cancer Society Smoking Linked to Increased Colorectal Cancer Risk - New Study Links Smoking to Increased Colorectal Cancer Risk 06/12/2000
- ↑ «'Smoking Ups Colon Cancer Risk'» at Medline Plus
- ↑ Decreased incidence of prostate cancer with selenium supplementation: results of a double-blind cancer prevention trial
- ↑ «Selenium from High Selenium Broccoli Protects Rats from Colon Cancer» at Journal of Nutrition
- ↑ a b Gregory L. Brotzman and Russell G. Robertson (2006). «Colorectal Cancer Risk Factors». Colorectal Cancer. Armenian Health Network, Health.am. Consultado em 16 de janeiro de 2008
- ↑ Jerome J. DeCosse, MD; George J. Tsioulias, MD; Judish S. Jacobson, MPH (fevereiro de 1994). «Colorectal cancer: detection, treatment, and rehabilitation» (PDF). A Cancer Journal for Clinicians. Colorectal cancer: detection, treatment, and rehabilitation. Consultado em 16 de janeiro de 2008. Arquivado do original (PDF) em 26 de fevereiro de 2008
- ↑ Hamilton SR. Colorectal Carcinoma in patients with Crohn's Disease. Gastroenterology 1985; 89; 398-407
- ↑ DO SANTOS SILVA I. ; SWERDLOW A. J. (2007). «Sex differences in time trends of colorectal cancer in England and Wales: the possible effect of female hormonal factors.». Familial relative risk of colorectal cancer: a population-based study. British journal of cancer. 73 (ISSN 0007-0920). 692 páginas
- ↑ Beral V, Banks E, Reeves G, Appleby P. Use of HRT and the subsequent risk of cancer. Imperial Cancer Research Fund Cancer Epidemiology Unit, Oxford, UK. 1999;4(3):191-210; discussion 210-5. PMID 10695959.
- ↑ a b c National Institute on Alcohol Abuse and AlcoholismAlcohol and Cancer - Alcohol Alert No. 21-1993
- ↑ Longnecker, M.P. Alcohol consumption in relation to risk of cancers of the breast and large bowel. Alcohol Health & Research World 16(3)':223-229, 1992.
- ↑ «Longnecker, M.P.; Orza, M.J.; Adams, M.E.; Vioque, J.; and Chalmers, T.C. A meta-analysis of alcoholic beverage consumption in relation to risk of colorectal cancer»Cancer Causes and Control 1(1):59-68, 1990.
- ↑ «Kune, S.; Kune, G.A.; and Watson, L.F. Case-control study of alcoholic beverages as etiological factors: The Melbourne Colorectal Cancer Study» Nutrition and Cancer 9(1):43-56, 1987.
- ↑ «Potter, J.D., and McMichael, A.J. Diet and cancer of the colon and rectum: A case-control study» Journal of the National Cancer Institute 76(4):557-569, 1986.
- ↑ «Alcohol Consumption and the Risk for Colorectal Cancer» 20 April 2004
- ↑ Alcohol Intake and Colorectal Cancer: A Pooled Analysis of 8 Cohort Studies
- ↑ Boston University "Alcohol May Increase the Risk of Colon Cancer" Arquivado em 13 de março de 2007, no Wayback Machine.
- ↑ Su LJ, Arab L. Alcohol consumption and risk of colon cancer: evidence from the National Health and Nutrition Examination Survey I Epidemiologic Follow-Up Study. Nutr and Cancer. 2004;50(2):111–119.
- ↑ Cho E, Smith-Warner SA, Ritz J, van den Brandt PA, Colditz GA, Folsom AR, Freudenheim JL, Giovannucci E, Goldbohm RA, Graham S, Holmberg L, Kim DH, Malila N, Miller AB, Pietinen P, Rohan TE, Sellers TA, Speizer FE, Willett WC, Wolk A, Hunter DJ Alcohol intake and colorectal cancer: a pooled analysis of 8 cohort studiesAnn Intern Med April 20, 2004;140(8):603-13
- ↑ Joseph C. Anderson, Zvi Alpern, Gurvinder Sethi, Catherine R. Messina, Carole Martin, Patricia M. Hubbard, Roger Grimson, Peter F. Ells, and Robert D. Shaw Prevalence and Risk of Colorectal Neoplasia in Consumers of Alcohol in a Screening Population Am J Gastroenterol Volume 100 Issue 9 Page 2049 Date September 2005
- ↑ Brown, Anthony J. Alcohol, tobacco, and male gender up risk of earlier onset colorectal cancer Arquivado em 3 de setembro de 2009, no Wayback Machine.
- ↑ «Colorectal Cancer: Who's at Risk?». Consultado em 31 de agosto de 2009. Arquivado do original em 16 de fevereiro de 2007 (National Institutes of Health: National Cancer Institute)
- ↑ National Cancer Institute (NCI) Cancer Trends Progress Report Alcohol Consumption Arquivado em 16 de dezembro de 2012, no Wayback Machine.
- ↑ Ionov Y, Peinado MA, Malkhosyan S, Shibata D, Perucho M (1993). «Ubiquitous somatic mutations in simple repeated sequences reveal a new mechanism for colonic carcinogenesis». Nature. 363 (6429): 558–61. PMID 8505985. doi:10.1038/363558a0
- ↑ Srikumar Chakravarthi, Baba Krishnan, Malathy Madhavan. Apoptosis and expression of p53 in colorectal neoplasms. Indian J Med Res 111,1999;95-102
- ↑ «Implementing Colorectal Cancer Screening. Workshop Summary». The National Academies Press. 11 de dezembro de 2008. Consultado em 19 de dezembro de 2008. Arquivado do original em 24 de abril de 2009
- ↑ Weitzel JN: Genetic cancer risk assessment. Putting it all together. Cancer 86:2483,1999. PMID 10630174
- ↑ B. Greenwald (2006). «The DNA Stool Test - An Emerging Technology in Colorectal Cancer Screening»[ligação inativa]
- ↑ Pathology atlas
- ↑ AJCC Cancer Staging Manual Sixth Edition ed. [S.l.]: Springer-Verlag New York, Inc. 2002
- ↑ Winawer SJ, Zauber AG, Ho MN, O'Brien MJ, Gottlieb LS, Sternberg SS, Waye JD, Schapiro M, Bond JH, Panish JF, Ackroyd F, Shike M, Kurtz RC, Hornsby-Lewis L, Gerdes H, Stewart ET, The National Polyp Study Workgroup. Prevention of colorectal cancer by colonoscopic polypectomy. New England Journal of Medicine 1993;329:1977-81. PMID 8247072.
- ↑ Cummings, JH; Bingham SA (1998). «Diet and the prevention of cancer». BMJ (317): 1636–40. PMID 9848907
- ↑ Fuchs, C. S. (1999). «Dietary Fiber and the Risk of Colorectal Cancer and Adenoma in Women». New England Journal of Medicine. 340 (340): 169–76. PMID 9895396. doi:10.1056/NEJM199901213400301
- ↑ Baron, J. A. (2005). «Dietary Fiber and Colorectal Cancer: An Ongoing Saga». Journal of the American Medical Association. 294 (294(22)): 2904–2906. PMID 16352792. doi:10.1001/jama.294.22.2904
- ↑ «Colorectal Cancer Prevention: Chemoprevention Database». Consultado em 23 de agosto de 2007. Arquivado do original em 9 de dezembro de 2006
- ↑ Flossmann E, Rothwell PM (2007). «Effect of aspirin on long-term risk of colorectal cancer: consistent evidence from randomised and observational studies». Lancet. 369(9573): 1603–13. PMID 17499602. doi:10.1016/S0140-6736(07)60747-8 PMID 17499602
- ↑ Campbell CL, Smyth S, Montalescot G, Steinhubl SR (2007). «Aspirin dose for the prevention of cardiovascular disease: a systematic review». JAMA. 297 (18): 2018–24. PMID 17488967. doi:10.1001/jama.297.18.2018 PMID 17488967
- ↑ Agency for Healthcare Research and Quality (5 de março de 2007). «Task Force Recommends Against Use of Aspirin and Non-Steroidal Anti-Inflammatory Drugs to Prevent Colorectal Cancer». United States Department of Health & Human Services. Consultado em 7 de maio de 2007. Arquivado do original em 7 de maio de 2009
- ↑ Weingarten MA, Zalmanovici A, Yaphe J (2005). «Dietary calcium supplementation for preventing colorectal cancer and adenomatous polyps». Cochrane database of systematic reviews (Online) (3): CD003548. PMID 16034903. doi:10.1002/14651858.CD003548.pub3
- ↑ Wactawski-Wende J, Kotchen JM, Anderson GL, ; et al. (2006). «Calcium plus vitamin D supplementation and the risk of colorectal cancer». N. Engl. J. Med. 354 (7): 684–96. PMID 16481636. doi:10.1056/NEJMoa055222
- ↑ Lappe JM, Travers-Gustafson D, Davies KM, Recker RR, Heaney RP (2007). «Vitamin D and calcium supplementation reduces cancer risk: results of a randomized trial». Am. J. Clin. Nutr. 85 (6): 1586–91. PMID 17556697
- ↑ Ades, Steven (2009). «Adjuvant chemotherapy for colon cancer in the elderly». [Oncology]
- ↑ Parker MC, Wilson MS, Menzies D, Sunderland G, Clark DN, Knight AD, Crowe AM; Surgical and Clinical Adhesions Research (SCAR) Group. (2005). «The SCAR-3 study: 5-year adhesion-related readmission risk following lower abdominal surgical procedures.». Colorectal Dis. 7(6): 551–558. PMID 16232234. doi:10.1111/j.1463-1318.2005.00857.x. Consultado em 5 de março de 2009[ligação inativa]
- ↑ a b L. van Epps, PhD, Heather (inverno de 2008). «Bittersweet Gene: A gene called KRAS can predict which colorectal cancers will respond to a certain type of treatment—and which will not.». CURE (Cancer Updates, Research and Education)
- ↑ «ASCO Releases Provisional Clinical Opinion Recommending Routine KRAS Gene Testing to Guide Treatment for Metastatic Colorectal Cancer». Consultado em 31 de agosto de 2009. Arquivado do original em 16 de fevereiro de 2009
- ↑ PGxNews.Org (julho de 2009). «FDA updates Vectibix and Erbitux labels with KRAS testing info». PGxNews.Org. Consultado em 20 de julho de 2009
- ↑ V. Shankaran, et al. "Economic implications of Kras testing in metastatic colorectal cancer (mCRC)" ASCO 2009 Gastrointestinal Cancers Symposium, abstract #298; http://www.asco.org/ASCO/Abstracts+&+Virtual+Meeting/Abstracts?&vmview=abst_detail_view&confID=63&abstractID=10759.
- ↑ Simmonds PC, Primrose JN, Colquitt JL, Garden OJ, Poston GJ, Rees M (abril de 2006). «Surgical resection of hepatic metastases from colorectal cancer: a systematic review of published studies». Br. J. Cancer. 94 (7): 982–99. PMID 16538219. doi:10.1038/sj.bjc.6603033
- ↑ Mosolits S, Nilsson B, Mellstedt H. Towards therapeutic vaccines for colorectal carcinoma: a review of clinical trials., Expert Rev. Vaccines, 2005;4:329-50. PMID 16026248.
- ↑ Wheldon, Julie. Vaccine for kidney and bowel cancers 'within three years' The Daily Mail 13 de novembro de 2006
- ↑ Vaccine Works With Chemotherapy in Colorectal Cancer (Reuters) 13 de agosto de 2007[ligação inativa]
- ↑ INFOCANCRO - APOIO AO DOENTE COM CANCRO
- ↑ «JAMA -- Abstract: Long-term Use of Aspirin and Nonsteroidal Anti-inflammatory Drugs and Risk of Colorectal Cancer, August 24/31, 2005, Chan et al. 294 (8): 914»
- ↑ a b NCCN Clinical Practice Guidelines in Oncology - Colon Cancer (version 1, 2008: September 19, 2007).
- ↑ a b Desch CE, Benson AB 3rd, Somerfield MR, ; et al. (2005). American Society of Clinical Oncology, ed. «Colorectal cancer surveillance: 2005 update of an American Society of Clinical Oncology practice guideline» (PDF). J Clin Oncol. 23 (33): 8512–9. PMID 16260687. doi:10.1200/JCO.2005.04.0063. Consultado em 31 de agosto de 2009. Arquivado do original (PDF) em 25 de março de 2009
- ↑ Jeffery M, Hickey BE, Hider PN (2002). «Follow-up strategies for patients treated for non-metastatic colorectal cancer». Cochrane Database Syst Rev. doi:10.1002/14651858.CD002200. CD002200
- ↑ Renehan AG, Egger M, Saunders MP, O'Dwyer ST (2002). «Impact on survival of intensive follow up after curative resection for colorectal cancer: systematic review and meta-analysis of randomised trials». BMJ. 324(7341): 831–8. PMID 11934773. doi:10.1136/bmj.324.7341.813
- ↑ Figueredo A, Rumble RB, Maroun J,; et al. (2003). «Follow-up of patients with curatively resected colorectal cancer: a practice guideline.». Gastrointestinal Cancer Disease Site Group of Cancer Care Ontario's Program in Evidence-based Care. BMC Cancer. 3. 26 páginas. doi:10.1186/1471-2407-3-26
- ↑ Pinheiro, P. S., et al (2002). Cancer in Portugal / Cancro em Portugal. IARC Technical Publication, 38, 36-37
- ↑ «Estimativa 2008 - Incidência de Câncer no Brasil». Consultado em 31 de agosto de 2009. Arquivado do original em 3 de setembro de 2009
- ↑ Colon Cancer (Colorectal Cancer)