Malária
| Malária | |
|---|---|
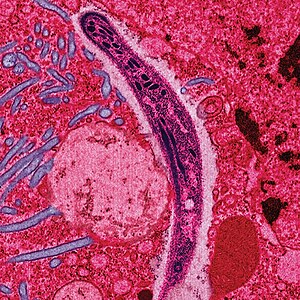
| O parasita Plasmodium ao atravessar o citoplasma de umacélula epitelial da fêmea do mosquito, na forma com que penetra no corpo do ser humano e de outros vertebrados. | |
| Sinónimos | Paludismo, impaludismo, maleita |
| Especialidade | Infectologia |
| Sintomas | Febre, vómitos, dores de cabeça[1] |
| Complicações | Icterícia, convulsões, coma[1] |
| Início habitual | 10–15 dias após exposição[2] |
| Causas | Parasita Plasmodium transmitido por mosquitos[1] |
| Método de diagnóstico | Análises ao sangue, testes de diagnóstico rápido de malária[1] |
| Prevenção | Redes mosquiteiras, repelente de insetos, controlo biológico dos mosquitos, medicação[1] |
| Medicação | Antimaláricos[2] |
| Frequência | 216 milhões (2016)[3] |
| Mortes | 730 500 (2015)[4] |
| Classificação e recursos externos | |
| CID-10 | B50-B54 |
| CID-9 | 084 |
| OMIM | 248310 |
| DiseasesDB | 7728 |
| MedlinePlus | 000621 |
| eMedicine | med/1385 emerg/305 ped/1357 |
| MeSH | D008288 |
Malária é uma doença infecciosa transmitida por mosquitos e causada por protozoários parasitários do género Plasmodium.[2] Os sintomas mais comuns são febre, fadiga, vómitos e dores de cabeça.[1] Em casos graves pode causar icterícia, convulsões, coma ou morte.[1] Os sintomas começam-se a manifestar entre 10 e 15 dias após a picada.[2] Quando não é tratada, a doença pode recorrer meses mais tarde.[2] Uma nova infeção geralmente causa sintomas mais ligeiros.[1] No entanto, esta imunidade parcial pode desaparecer no prazo de meses a anos se a pessoa não for continuamente exposta à doença.[1]
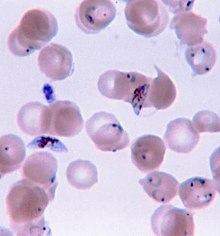
A doença é geralmente transmitida pela picada de uma fêmea infectada do mosquito Anopheles.[2] A picada introduz no sistema circulatório do hospedeiro os parasitas presentes na sua saliva.[2]Os parasitas depositam-se no fígado, onde se desenvolvem e reproduzem.[1] Existem cinco espécies de Plasmodium que podem infetar os seres humanos.[1] A maior parte das mortes são causadas pelo P. falciparum. As espécies P. vivax, P. ovale e P. malariaegeralmente causam formas menos graves de malária que raramente são fatais.[1][2] A espécie P. knowlesi raramente causa a doença em seres humanos.[2] O diagnóstico de malária tem por base análises microscópicas ao sangue que confirmem a presença do parasita ou através testes de diagnóstico rápido que detectam a presença de antigénios no sangue.[1] Existem também técnicas de diagnóstico que usam a Reação em cadeia da polimerase para detectar o ADNdo parasita, embora o seu uso nas regiões onde a doença é endémica seja pouco comum devido ao seu elevado custo e complexidade.[5]
A transmissão da doença pode ser combatida através da prevenção das picadas de mosquito. As medidas de prevenção mais comuns são o uso de redes mosquiteiras ou repelente de insetos e medidas de erradicação, como o uso de inseticidas ou o escoamento de águas estagnadas.[1] Estão disponíveis diversos medicamentos para prevenção da malária em viajantes que se desloquem a países onde a doença seja endémica.[2] Em regiões de elevada incidência, está recomendada a administração de sulfadoxina/pirimetamina nas crianças mais novas e em grávidas após o primeiro trimestre.[2] Não existe vacina eficaz contra a malária, apesar de haver esforços no sentido de desenvolver uma.[2] O tratamento recomendado para a malária é uma artemisinina associada a um segundo antimalárico.[1][2] Os antimaláricos são geralmente mefloquina, lumefantrina ou sulfadoxina/pirimetamina.[6] Quando não está disponível artemisinina pode ser usada quinina com doxiciclina.[6]Em áreas onde a doença é comum, recomenda-se que se confirme a presença da doença antes de iniciar o tratamento devido à preocupação com a crescente resistência farmacológica.[2]Vários parasitas desenvolveram resistência a uma série de antimaláricos, como é o caso do P. falciparum resistente o quinino e a resistência a artemisinina em várias partes do Sudeste Asiático.[2]
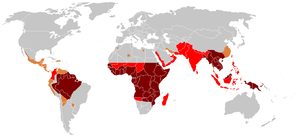
A malária é endémica em regiões tropicais e subtropicais devido à chuva abundante, temperatura quente e grande quantidade de água estagnada, o que proporciona habitats ideais para as larvas do mosquito. A doença encontra-se disseminada pelas regiões tropicais e subtropicais do planeta ao longo de uma larga faixa em redor do equador,[1] que inclui grande parte da África subsariana, Ásia e América Latina.[2] Em 2016, ocorreram em todo o mundo 216 milhões de casos de malária, que se estima terem sido a causa de 731 000 mortes.[3][4] Cerca de 90% dos casos e da morte ocorreram em África.[7] Entre 2000 e 2015 a incidência da doença diminuiu 37%,[7][8] A malária está geralmente associada à pobreza e tem um grande impacto negativo no desenvolvimento económico.[9][10] Em África, estima-se que a doença resulte em perdas de 12 mil milhões de dólares por ano devido aos custos com a prestação de cuidados de saúde, baixas de trabalho e impacto no turismo.[11]
Índice
Sinais e sintomas[editar | editar código-fonte]
Os sinais e sintomas da malária manifestam-se geralmente entre 8 a 25 dias após a infecção.[12] No entanto, os sintomas podem-se manifestar mais tarde em indivíduos que tenham tomado medicação antimalárica de prevenção.[5] As manifestações iniciais da doença, iguais em todas as espécies de malária, são semelhantes aos sintomas da gripe,[13] podendo ainda ser semelhantes aos de outras doenças virais e condições clínicas como a sepse ou gastroenterite.[5] Entre os sinais incluem-se dores de cabeça, febre, calafrios, dores nas articulações, vómitos, anemia hemolítica, icterícia, hemoglobina na urina, lesões na retina e convulsões.[14]
O sintoma clássico da malária são ataques paroxísticos, a ocorrência cíclica de uma sensação súbita de frio intenso seguida por calafrios e posteriormente por febre e sudação. Estes sintomas ocorrem a cada dois dias em infecções por P. vivax e P. ovale e a cada três dias em infecções por P. malariae. A infecção por P. falciparum pode provocar febre recorrente a cada 36-48 horas ou febre menos aguda, mas contínua.[15]
Os casos mais graves de malária são geralmente provocados por P. falciparum, variante que é muitas vezes denominada "malária falciparum". Os sintomas desta variante manifestam-se entre 9 a 30 dias após a infecção.[13] Os indivíduos com ‘’’malária cerebral’’’ apresentam muitas vezes sintomas neurológicos, entre os quais postura anormal, nistagmo, paralisia do olhar conjugado (incapacidade de mover em conjunto os olhos na mesma direção), opistótono, convulsões ou coma.[13]
Complicações[editar | editar código-fonte]
Existem diversas complicações graves de malária. Entre elas está o desenvolvimento de ’’stress’’ respiratório, no qual se verifica a necessidade de um esforço cada vez maior para respirar associado a sensação de desconforto psicológico, o qual ocorre em 25% dos adultos e 40% das crianças com malária falciparum aguda. Entre as possíveis causas estão a compensação respiratória da acidose metabólica, edema pulmonar não cardiogénico, pneumonia concomitante e anemia grave. Embora a sua ocorrência seja rara em crianças, entre 5% e 25% dos adultos e 29% das grávidas com casos graves de malária desenvolvem Síndrome do desconforto respiratório do adulto.[16] A co-infecção de malária com VIH aumenta a mortalidade.[17] Pode ainda ocorrer febre da água negra, uma complicação na qual a hemoglobina de glóbulos vermelhos danificados se deposita na urina[13]
A infecção com P. falciparum pode provocar malária cerebral, uma forma grave de malária que envolve encefalopatia. Manifesta-se através do branqueamento da retina, o que pode constituir um sinal clínico auxiliar para distinguir a malária de outras causas de febre.[18] Pode também ocorrer esplenomegalia, dor de cabeça intensa, hepatomegalia, hipoglicemiaou hemoglobinúria com insuficiência renal.[13] Em casos de malária durante a gravidez, entre as complicações graves estão a morte do feto ou da criança, ou peso à nascença inferior a 2,5 kg,[19] em particular na infecção por P. falciparum, mas também por P. vivax.[20]
Causas[editar | editar código-fonte]
Os parasitas da malária pertencem ao género Plasmodium (filo Apicomplexa). No ser humano, a malária é provocada por P. falciparum, P. malariae, P. ovale, P. vivax e P. knowlesi.[21][22] Entre a população infectada, a espécie com maior prevalência é a P. falciparum (~75%), seguida pela P. vivax (~20%).[5] Embora a P. falciparum seja a responsável pela maioria das mortes,[23] existem dados recentes que sugerem que a malária por P. vivax está associada a condições que colocam a vida em risco em igual número com a infecção por P. falciparum.[24] A P. vivax é, em proporção, mais comum fora de África.[25] Estão também documentadas várias infecções humanas com diversas espécies de Plasmodium de origem símia; no entanto, com a exceção da P. knowlesi – uma espécie zoonótica que provoca malária nos macacos[22] – a relevância para a saúde pública destas infecções é apenas residual.[26]
Ciclo de vida do parasita[editar | editar código-fonte]
No ciclo de vida do Plasmodium, a fêmea do mosquito Anopheles (o hospedeiro definitivo) transmite a um vertebrado (o hospedeiro secundário, como o ser humano) uma forma infecciosa móvel (denominada esporozoíto), atuando desta forma como vetor. O esporozoíto percorre os vasos sanguíneos até às células hepáticas, nas quais se reproduz assexualmente (através de esquizogonia tecidual), produzindo milhares de merozoítos. Estes últimos irão infectar mais glóbulos vermelhos e dar início a uma série de ciclos de multiplicação assexuada que produzem entre 8 a 24 novos merozoítos infecciosos cada um, até à célula romper e dar início a um novo ciclo de infecção.[27]
Os restantes merozoítos tornam-se gametócitos imaturos, os quais são os precursores dos gâmetas masculinos e femininos. Quando um mosquito pica uma pessoa infectada, os gametócitos são transportados no sangue e amadurecem no sistema digestivo do mosquito. Os gametócitos macho e fêmea fundem-se e formam um oocineto – um zigotofertilizado móvel. Por sua vez, os oocinetos transformam-se em novos esporozoítos que migram para as glândulas salivares do insecto, prontos a infectar novos vertebrados. Quando o mosquito se alimenta através da picada, os esporozoítos são injectados para a pele através da sua saliva.[28]
Só a fêmea do mosquito é que se alimenta de sangue; os machos alimentam-se do néctar de plantas, pelo que não transmitem a doença. As fêmeas do género Anophelespreferem alimentar-se ao longo da noite, iniciando a procura de uma refeição com o pôr do sol.[29] Os parasitas da malária podem também ser transmitidos através de transfusões de sangue, embora a sua ocorrência seja rara.[30]
Malária recorrente[editar | editar código-fonte]
Os sintomas da malária podem ocorrer novamente após períodos sem qualquer sintoma. Dependendo da causa, a recorrência pode ser classificada em recrudescência, recidiva ou reinfecção. A recrudescência verifica-se quando se manifestam novamente sintomas após um período sem qualquer sintoma. É provocada por parasitas no sangue que sobreviveram a um tratamento inadequado ou ineficaz.[31] As recidivas ocorrem quando reaparecem sintomas mesmo após os parasitas terem sido eliminados do sangue, devido à persistência de populações de hipnozoítos adormecidos nas células do fígado. As recidivas ocorrem frequentemente entre 8 a 24 semanas e são mais frequentes nas infecções por P. vivax e P. ovale.[5] Nos casos de malária por P. vivax em regiões de clima temperado, é comum que os hipnozoítos adormeçam durante o inverno, iniciando-se as recidivas no ano seguinte à picada do mosquito.[32] A reinfecção verifica-se quando o parasita que provocou a infecção anterior foi completamente eliminado do corpo, mas foi introduzido um novo parasita. É difícil distinguir a reinfecção da recrudescência, embora a ocorrência de uma nova infecção no prazo de duas semanas após o tratamento da infecção inicial seja normalmente atribuída ao insucesso desse tratamento.[33]
Fisiopatologia[editar | editar código-fonte]
A infecção de malária desenvolve-se em duas fases: uma que envolve o fígado(fase exoeritrocítica) e outra que envolve os glóbulos vermelhos, ou eritrócitos (fase eritrocítica). Quando um mosquito infectado perfura a pele de uma pessoa para se alimentar de sangue, os esporozoítos presentes na saliva do mosquito penetram na corrente sanguínea e depositam-se no fígado, onde infectam os hepatócitos, reproduzindo-se assexualmente e sem haver manifestação de sintomas ao longo de 8-30 dias.[34]
Depois de um período de dormência no fígado, estes organismos diferenciam-separa produzir milhares de merozoítos, os quais, após romperem as células hospedeiras, se introduzem na corrente sanguínea e infectam os glóbulos vermelhos, dando início à fase eritrocítica do ciclo de vida.[34] O parasita é capaz de abandonar o fígado sem ser detectado, ao se envolver com a membrana celular da célula hepática do hospedeiro.[35] No interior dos glóbulos vermelhos, os parasitas reproduzem-se novamente, também de forma assexuada, rompendo periodicamente as células hospedeiras para infectar novos glóbulos vermelhos.[34]
Alguns esporozoítos P. vivax não se desenvolvem imediatamente em merozoítos, produzindo em vez disso hipnozoítos que permanecem adormecidos por intervalos de tempo que variam entre alguns meses, geralmente 7 a 10 meses, e vários anos. Após o período de hibernação, os hipnozoítos são reativados e produzem merozoítos. Os hipnozoítos são responsáveis pelos longos períodos de incubação e recidivas tardias em infecções por P. vivax,[32] embora se desconheça ainda a sua existência em casos de P. ovale.[36]
O parasita encontra-se relativamente protegido de ataques do sistema imunitário do corpo, uma vez que durante a maior parte do seu ciclo de vida humano se encontra no interior das células do fígado e dos glóbulos vermelhos, sendo por isso relativamente invisível à vigilância imunitária. No entanto, os glóbulos vermelhos infectados em circulação são destruídos no baço. Para evitar a sua destruição, o parasita P. falciparum introduz proteínas adesivas na superfície dos glóbulos vermelhos infectados, o que faz com que os glóbulos se agarrem às paredes dos vasos sanguíneos mais pequenos e não tenham que percorrer o sistema circulatório e passar pelo baço.[37] O bloqueio dos vasos pode provocar malária placentária.[38] Os glóbulos vermelhos sequestrados podem penetrar na barreira hematoencefálica e provocar malária cerebral.[39]
Resistência genética[editar | editar código-fonte]
De acordo com uma revisão de 2005, os elevados níveis de letalidade e morbidade provocados pela malária, especialmente pela espécie P. falciparum, são responsáveis pela maior pressão seletiva sobre o genoma humano da história recente. Algumas características genéticas proporcionam alguma resistência à malária, entre os quais a anemia falciforme, talassemia, deficiência em glucose-6-fosfato desidrogenase e a ausência do antígeno de Duffy nos glóbulos vermelhos.[40][41]
A anemia falciforme provoca um defeito nas moléculas de hemoglobina do sangue. As moléculas de hemoglobina Sfazem com que os glóbulos vermelhos assumam uma forma curva semelhante a uma foice (falciforme), em vez da forma bicôncava normal. Devido a esta deformação, a molécula perde alguma da sua eficácia na absorção e libertação de oxigénio. A infeção faz com que os glóbulos vermelhos se curvem ainda mais, sendo por isso removidos de circulação mais cedo, o que por sua vez reduz a frequência com que os parasitas completam o seu ciclo de vida na célula. Os indivíduos homozigóticos (com duas cópias do alelo anormal) desenvolvem anemia falciforme, enquanto que os heterozigóticos (com um alelo anormal e outro normal) apresentam resistência à malária.[41][42]
Insuficiência hepática[editar | editar código-fonte]
É pouco comum a ocorrência de insuficiência hepática provocada por malária, sendo geralmente o resultado da coexistência com outras condições que afectam o fígado, como a hepatite viral ou qualquer doença crónica do fígado. A síndrome é por vezes denominada “hepatite malárica”. Embora a sua ocorrência seja ainda considerada rara, a hepatopatia malárica tem vindo a aumentar, sobretudo na Índia e no Sudeste Asiático. A presença de doenças hepáticas em pacientes de malária aumenta a probabilidade de complicações ou morte.[43]
Diagnóstico[editar | editar código-fonte]
Devido à natureza não específica dos sintomas, o diagnóstico de malária em regiões onde não seja endémica exige confirmação redobrada e deve levar em conta factores de diagnóstico auxiliares, como o histórico recente de viagens, aumento de volume do baço, febre, número reduzido de plaquetas no sangue e quantidade de bilirrubina no sangue superior ao normal com quantidade normal de glóbulos brancos.[5]
A malária é geralmente confirmada através de exame microscópico de esfregaços ou através de testes de diagnóstico rápido (DRT) baseados na deteção de antígenos.[44][45] A microscopia é o método mais comum na deteção do parasita.[46] No entanto, apesar do seu uso generalizado, o diagnóstico por microscopia tem duas desvantagens: muitos locais, sobretudo em meios rurais, não têm equipamento para a realização do exame e a precisão dos resultados depende da destreza do examinador e da quantidade de parasitas no sangue. A sensibilidade dos esfregaços varia entre 75–90% em condições normais, podendo diminuir até 50%. Os testes de diagnóstico rápido disponíveis são mais precisos a determinar a presença de parasitas da malária do que a análise microscópica, embora a sua sensibilidade e especificidade dependam do fabricante e não sejam capazes de determinar o número de parasitas.[46]
Em regiões onde estejam disponíveis análises de laboratório, deve-se suspeitar a presença de malária em qualquer paciente que manifeste sintomas e que tenha estado numa região onde a malária seja endémica. Em regiões onde não há capacidade de disponibilizar facilmente análise laboratorial, tem vindo a tornar-se rotina usar apenas o histórico de febre subjetiva como indicador de tratamento para malária – um diagnóstico presuntivo que assume que febre corresponde a malária, a não ser que haja prova em contrário. Uma desvantagem desta prática é o sobrediagnóstico de malária e a gestão inadequada de casos de febre sem relação com a malária, o que desperdiça recursos, diminui a confiança no sistema de saúde e aumenta a resistência a fármacos.[47] Embora tenham já sido desenvolvidos testes que têm por base a reação em cadeia da polimerase, não estão ainda difundidos pelas regiões onde a malária é endémica devido à sua complexidade.[5]
Classificação[editar | editar código-fonte]
A Organização Mundial de Saúde (OMS) classifica a malária em “grave” ou “não complicada”.[5] Classifica-se como grave quando está presente ‘’qualquer um’’ dos seguintes critérios; caso contrário, é considerada não complicada.[48]
- Alteração do estado de consciência ou coma
- Fraqueza significativa, de tal forma que a pessoa não é capaz de caminhar
- Incapacidade de se alimentar
- Mais de dois episódios de convulsões em menos de 24 horas
- Choque circulatório e Pressão arterial baixa (inferior a 70 mmHg em adultos e 50 mmHg em crianças)
- Respiração profunda (respiração acidótica)
- Icterícia
- Insuficiência renal ou hemoglobina na urina (creatinina sérica > 265 mmol/L ou > 3 mg/dL)
- Hemorragia espontânea, ou hemoglobina inferior a 50 g/L (5 g/dL)
- Edema pulmonar
- Hipoglicemia (glicose inferior a 2,2 mmol/L ou 40 mg/dL)
- Acidose metabólica (bicarbonato plasmático <15 li="" mmol="" nbsp="">
- Anemia normocítica grave (Hb < 5 g/dL, hematrócrito <15 li="">
- Hiperlactacidémia (lactato >5 mmol/L)
- Contagem de parasitas no sangue superior a 100 000 por microlitro (µL) em áreas de transmissão de pouca intensidade, ou 250 000 por µL em áreas de transmissão de elevada intensidade
Define-se por malária cerebral a malária P. falciparum grave que apresente sintomas neurológicos, entre os quais coma(inferior a 11 na escala de coma de Glasgow ou superior a 3 na escala de Blantyre), ou coma com duração superior a 30 minutos após uma convulsão.[49]
Prevenção[editar | editar código-fonte]
Entre os métodos de prevenção da malária estão a erradicação dos mosquitos, a prevenção de picadas e medicação. A presença de malária numa dada região pressupõe a conjugação de vários factores: elevada densidade populacional humana, elevada densidade populacional de mosquitos ‘’anopheles’’ e elevada taxa de transmissão entre humanos e mosquito e vice-versa. Quando algum destes factores é reduzido de forma significativa, o parasita irá eventualmente desaparecer dessa região, tal como aconteceu na América do Norte, Europa e partes do Médio Oriente. No entanto, a não ser que o parasita seja erradicado à escala global, pode-se voltar a implantar em qualquer uma dessas regiões caso ocorra uma conjugação de factores que proporcione a sua reprodução. Além disso, o custo económico da erradicação do mosquito por pessoa é maior em áreas com menor densidade populacional, o que faz com que seja economicamente invável em algumas regiões.[50]
Muitos investigadores defendem que, a longo prazo, a prevenção da malária é capaz de representar uma maior relação custo-benefício do que o tratamento da doença. No entanto, as regiões mais pobres e afetadas não dispõem de capital financeiro. Há diferenças significativas entre os custos de controlo (isto é, manter a endemicidade baixa) e os programas de erradicação entre os vários países. Por exemplo, na China, cujo governo anunciou em 2010 um programa estratégico para a eliminação da malária nas províncias, o investimento necessário representa apenas uma pequena parcela dos gastos em saúde. Em contrapartida, um programa semelhante na Tanzânia custaria um quinto do total do orçamento de saúde.[51]
Controlo do mosquito[editar | editar código-fonte]
Os métodos usados para reduzir a malária através da diminuição do número de transmissões são denominados controlo de vetores. Em termos de proteção individual, os repelentes de insetos à base de DEET ou Icaridina são os mais eficazes.[52] A vaporização residual de interiores com inseticida e o uso de redes mosquiteiras, às quais é aplicado também inseticida, são outras técnicas de erradicação que têm demonstrado ser altamente eficazes na prevenção de malária em regiões endémicas.[53][54]
Vaporização residual designa uma técnica que consiste na vaporização de inseticida nas paredes interiores de casas em regiões afetadas pela malária. Depois de se alimentarem, muitas espécies de mosquito descansam numa superfície próxima enquanto digerem o sangue. Se as paredes da habitação tiverem sido revestidas com inseticida, é provável que o mosquito morra antes de picar outra pessoa e trensferir o parasita da malária.[55] À data de 2006, a Organização Mundial de Saúde recomenda o uso de doze inseticidas para ações de vaporização residual, entre os quais DDT e os piretoides ciflutrina e deltametrina.[56] O uso de pequenas quantidades de DDT para ações de saúde pública é autorizado pela Convenção de Estocolmo para os poluentes orgânicos persistentes, a qual proíbe o seu uso na agricultura.[57] Um dos problemas da vaporização residual é a resistência ao pesticida. Os mosquitos afetados pela vaporização geralmente vivem e descansam no interior das habitações e, devido à irritação provocada pela vaporização, os seus descendentes tendem a viver no exterior, o que significa que serão menos afetados pela técnicas de vaporização residual.[58]
As redes mosquiteiras ajudam a manter os mosquitos afastados de pessoas e reduzem as taxas de infeção e transmissão de malária. No entanto, as redes não constituem uma barreira perfeita e são muitas vezes tratadas com um inseticida próprio para matar o mosquito antes que seja capaz de encontrar uma forma de passar a rede. Estima-se que as redes tratadas com inseticida sejam duas vezes mais eficazes que redes não tratadas e que ofereçam mais 70% de proteção quando comparada com os dados na ausência de qualquer rede.[59] Entre 2000 e 2008, o uso de redes tratadas com inseticida salvou a vida a mais de 250 000 crianças na África Subsariana.[60] Embora as redes com inseticida possam prevenir a malária, só estão presentes em cerca de 13% dos lares nos países subsarianos.[61] O método de uso recomendado é a suspensão de uma rede de grande dimensão por cima do centro da cama, de modo a envolvê-la por completo, e amarrar as pontas. As redes tratadas com piretroides e inseticidas de longa duração proporcionam a proteção pessoal mais eficaz, sobretudo quando usadas desde o anoitecer ao amanhecer.[62] Usando uma ferramenta de edição de gene conhecido como CRISPR/Cas9, em 2015, pesquisadores fizeram uma "vacina genética" que continuamente injetar-se no DNA de mosquitos. Uma vacina deste tipo, conhecida como uma unidade de gene, pode difundir para quase todos os mosquitos numa população em algumas gerações.[63] Um método para prevenir a transmissão da malária que consiste em limitar o acesso de mosquitos a casas, bloqueando aberturas e instalação de tubos "eave" que contêm um tipo único de ataque com mosquiteiro com inseticida que mata os insetos quando eles tentam entrar, recebeu $10,2 milhões de dolares da da Fundação Bill & Melinda Gates em 2015.[64]
Existem outros métodos destinados a reduzir o número de picadas de mosquito e abrandar a disseminação da malária. Uma vez que a larva do mosquito se desenvolve em águas estagnadas, drenar essa água ou acrescentar-lhe substâncias que diminuem o seu desenvolvimento é uma técnica eficaz nalgumas regiões.[65] No entanto, não há qualquer evidência que os aparelhos eletrónicos repelentes de insetos através de ultrassons sejam minimamente eficazes.[66]
Medicação[editar | editar código-fonte]
Existem diversos fármacos disponíveis para a prevenção de malária em viajantes que se desloquem para regiões onde a malária é endémica. Muitos destes fármacos são também usados no tratamento da doença. Nos casos em que o parasita ainda seja sensível, pode ser usada cloroquina.[67] No entanto, a maior parte dos Plasmodium é resistente a um ou mais fármacos, pelo que geralmente é necessário recorrer a outros fármacos ou a combinações entre fármacos. Entre estes estão a mefloquina, doxiciclina (disponível em genéricos) ou a combinação de atovaquona e proguanil.[67] A combinação entre doxiciclina e a combinação atovaquona-proguanil é a que é melhor tolerada pelo organismo. A mefloquina está associada a episódios de suicídio, morte e sintomas psiquiátricos.[67]
O efeito protetor não começa imediatamente após a primeira toma, pelo que os viajantes devem começar a tomar os medicamentos entre uma e duas semanas antes da chegada e continuar a tomá-los ao longo de duas semanas após terem deixado a região (à exceção da combinação atovaquona-proguanl, que só necessita de ser iniciada dois dias antes e prolongada por mais sete dias após).[68] O uso de fármacos preventivos não é prático para os residentes em regiões onde existe malária, pelo que o seu uso se restringe a viajantes e turistas de curta estadia. Isto deve-se ao preço dos medicamentos, aos efeitos secundários provocados pelo uso prolongado e à dificuldade em obter anti-maláricos fora dos países desenvolvidos.[69] O uso de fármacos preventivos nas regiões onde haja mosquitos podem contribuir para o desenvolvimento de resistência parcial.[70]
Outros métodos[editar | editar código-fonte]
Entre as comunidades dos países em vias de desenvolvimento, as campanhas de saúde que promovem a consciencialização para o problema da malária e a importância de medidas de controlo têm-se revelado eficazes para a redução da incidência da doença.[71] Identificar os estágios iniciais de malária pode impedir que a doença se torne fatal. As campanhas alertam também as pessoas no sentido de cobrirem áreas de água estagnada, como tanques ou depósitos, os quais são o meio ideal para a reprodução do mosquito e do parasita.[72] Outra intervenção que tem demonstrado ser eficaz no controlo da malária em grávidas e crianças é a Terapia Preventiva Intermitente, na qual é fornecida medicação anti-malárica a estes grupos de risco.[73][74]
Tratamento[editar | editar código-fonte]
A malária é tratada com medicação anti-malárica. A escolha do fármaco depende do tipo e gravidade da doença. Apesar de geralmente serem também usados medicamentos para baixar a febre, a sua influência no tratamento não é ainda conclusiva.[75]
A malária não complicada pode ser tratada com medicação oral. O tratamento mais eficaz para a infeção por P. falciparum é o uso de artemisinina combinada com outros anti-maláricos, denominada Terapia Combinada de Artemisinina ou ACT. A combinação de fármacos diminui as hipóteses de se verificar resistência do parasita a qualquer um dos componentes individuais.[76] Entre os outros anti-maláricos com que a artemisinina é combinada estão a amodiaquina, lumefantrina, mefloquina ou sulfadoxina/pirimetamina.[77] Outra combinação recomendada é a associação dihidroartemisinina-piperaquina.[78][79] A ACT é eficaz em 90% dos casos de tratamento de malária sem a presença complicações.[60] Para o tratamento de malária na gravidez, a OMS recomenda o uso de quinino e clindamicina no primeiro trimestre e ACT nos restantes trimestres.[80] Na década de 2000, surgiu no Sudeste Asiático malária parcialmente resistente a artemisinas.[81][82] A infeção por’P. vivax, P. ovale or P. malariae é geralmente tratada sem necessidade de internamento hospitalar. O tratamento de’P. vivax requer não só o tratamento das fases sanguíneas (com cloroquina ou ACT), como também da eliminação das formas hepáticas com primaquina.[83]
O tratamento recomendado para a malária grave é a administração intravenosa de fármacos anti-maláricos. Em casos graves, o artesunato é superior ao quinino, tanto em crianças como em adultos.[84] O tratamento de malária grave envolve medidas de apoio que são melhor realizadas numa unidade de cuidados intensivos, onde se possa gerir a febre elevada e as convulsões que dela derivam. As unidades hospitalares também permitem monitorizar o esforço respiratório, a descida da quantidade de açúcar no sangue e a descida da quantidade de potássio.[23]
Prognóstico[editar | editar código-fonte]
Quando tratada de forma adequada, uma pessoa com malária pode contar com recuperação total.[85] No entanto, a malária grave pode progredir muito rapidamente e provocar a morte num prazo de horas ou dias.[86] Nos casos mais graves da doença, a taxa de letalidadepode atingir os 20%, mesmo com cuidados intensivos.[5] Têm sido documentados casos de atraso no desenvolvimento a longo prazo de crianças que vivenciaram episódios de malária grave.[87]
Durante a infância, a malária pode provocar anemia ou, no caso de malária cerebral, lesões cerebrais.[87] Alguns dos sobreviventes de malária cerebral apresentam um risco acrescido de défice neurológico e cognitivo e manifestam transtornos emocionais e epilepsia.[88] Quando comparada com grupos placebo em ensaios clínicos, a profilaxia de malária demonstrou melhorar a função cognitiva e o desempenho escolar.[87]
Epidemiologia[editar | editar código-fonte]
A Organização Mundial de Saúde estima que em 2010 tenham ocorrido 219 milhões de casos de malária que provocaram a morte a 600 000 pessoas.[89][5] Outras fontes estimaram o número de casos entre 350 e 550 milhões para a malária falciparum[90] e 1,24 milhões de mortes em 2010,[91] uma subida em relação ao milhão de mortes estimado em 1990.[92] A maioria dos casos (65%) ocorre em crianças com idade inferior a 15 anos.[91] Cerca de 125 milhões de grávidas estão em risco de ser infetadas a cada ano. Na África subsariana, estima-se que a malária materna esteja associada à morte de 200 000 crianças anualmente.[19] Tanto a incidência global como a mortalidade que daí resulta têm vindo a diminuir nos últimos anos. De acordo com a OMS, as mortes atribuídas à malária em 2010 correspondem a uma diminuição de cerca de um terço, quando comparadas com a estimativa de 985 000 para o ano 2000, devido em grande parte à disseminação do uso de redes mosquiteiras tratadas com inseticida e da terapia combinada de artemisinina.[60]
A malária é atualmente endémica nas regiões equatoriais, em regiões da América, algumas partes da Ásia e grande parte de África. Entre 85 e 90% das mortes por malária ocorrem na África subsariana.[94] Em 2009, uma estimativa indicou que os países com a maior taxa de mortalidade por cada 100 000 habitantes foram a Costa do Marfim (86,15), Angola (56,93) e o Burkina Faso(50,66).[95] Em 2010, uma outra estimativa indicou que os países com maior taxa de mortalidade foram o Burkina Faso, Moçambiquee o Mali.[91] Ainda em 2010, cerca de 100 países possuíam malária endémica.[89][96] Estes países são visitados anualmente por mais de 125 milhões de viajantes internacionais, dos quais mais de 30 000 contraem a doença.[52]
Na Europa e na América do Norte, a doença está praticamente erradicada. Entre 1993 e 2003, a malária provocou a morte a 900 pessoas na Europa.[52] Em 2011 houve apenas 102 casos adquiridos in loco, restritos a cinco países.[97] Em Portugal, os últimos casos de Malária adquirida no país foram diagnosticados em 1959, e desde então a totalidade das ocorrências são casos importados por pessoas que visitaram países tropicais. Em 2011 foram notificados 58 casos importados de Malária.[98]
No Brasil, 97% dos casos ocorrem na região amazónica e pouco menos de 2,9% nas regiões próximas, sendo mais de 80% nas regiões rurais.[99] Em Moçambique, a malária é a principal causa de morte infantil. No entanto, entre 2006 e 2012 o número de casos de malária tem vindo a diminuir significativamente. Em 2006 registaram-se 6,5 milhões de casos, os quais provocaram 5053 mortes,[100] enquanto que em 2012 se registaram apenas 3,1 milhões de casos e 1653 mortes.[101] Em Angola, o número de casos também tem vindo a diminuir. Entre 2006 e 2010, registaram-se em média quatro milhões de casos por ano, enquanto que em 2011 se registou pela primeira vez um número inferior a três milhões.[102]
A distribuição geográfica da malária nas regiões de grande dimensão é complexa. Há muitos casos de regiões endémicas e regiões livres de malária que estão muito próximas entre si.[103] A malária é prevalente em regiões tropicais e subtropicais devido à chuva intensa, temperatura elevada constante e humidade elevada, factores que proporcionam água estagnada em abundância propícia à reprodução contínua de larvas de mosquito.[104] Em regiões mais secas, é possível prever com alguma precisão os surtos de malária através da previsão meteorológica da ocorrência de chuva.[105]A malária é mais frequente nas áreas rurais do que em área urbanas. Por exemplo, há várias cidades na bacia do rio Mekong que são livres de malária mas a doença é prevalente em muitas das regiões rurais.[106] Por outro lado, em África a malária está presente tanto em áreas rurais como urbanas, embora o risco seja menor nas maiores cidades.[107] É provável que as alterações climáticas venham a criar novos habitats para o mosquito vetor de malária em regiões mais frias e de maior altitude, provocando alterações na sua distribuição geográfica e o aumento de surtos epidémicos.[108]
História[editar | editar código-fonte]
Embora o parasita responsável pela malária falciparum exista há 50 000-100 000 anos, só há cerca de 10 000 anos é que a sua população aumentou, impulsionada pelo desenvolvimento da agricultura e o surgimento das primeiras cidades.[109] A presença de parentes dos parasitas da malária humana em chimpanzés continua a ser comum. Algumas evidências sugerem que a malária falciparum possa ter origem em gorilas.[110]
Desde 2700 a.C., na antiguidade chinesa, que são encontradas ao longo de toda a História escrita referências à febre periódica característica da malária.[111] A malária pode ter contribuído para o declínio do Império Romano,[112] onde era uma doença tão comum que chegou a ser conhecida como "febre romana".[113]Várias regiões do império eram consideradas de risco devido à presença de condições favoráveis aos vetores de malária, como o sul de Itália, a ilha de Sardenha, as lagoas Pontinas, as regiões baixas da costa da Etrúria e a cidade de Roma ao longo do rio Tibre. A presença de água estagnada nas terras alagadas e derivada da agricultura proporcionava aos mosquitos condições ideais de reprodução.[114]
O termo malária tem origem no italiano medieval mala aria, ou "maus ares"; a doença era anteriormente denominada "ague" ou "febre dos pântanos" devido à sua associação com os terrenos alagados.[115] A malária era comum em grande parte da Europa e da América do Norte,[116] onde já não é endémica,[117] embora continuem a ser registados casos importados.[118]
O primeiro progresso significativo na investigação científica da malária deu-se em 1880, data em que Charles Louis Alphonse Laveran, um médico francês que trabalhava no hospital militar de Constantina na Argélia, observou pela primeira vez os parasitas no interior dos glóbulos vermelhos de pessoas infectadas. Laveran propôs que este organismo seria a causa da malária, sendo também a primeira vez que um protista foi identificado como causa de uma doença.[119]Por esta e por descobertas posteriores, em 1907 foi agraciado com o Nobel de Medicina. Um ano mais tarde, Carlos Finlay, um médico cubano que tratava pacientes de febre amarela em Havana, apresentou evidências sólidas que os mosquitos eram os transmissores da doença.[120] Esta descoberta confirmou sugestões anteriores de Josiah C. Nott,[121]e Patrick Manson, considerado o pai da medicina tropical, sobre a transmissão da filaríase.[122]
Em abril de 1894, Patrick Manson e o médico escocês Ronald Ross iniciam uma colaboração ao longo de quatro anos, a qual culminaria em 1898 no momento em que Ross, que trabalhava no hospital geral de Calcutá, demonstra o ciclo de vida completo do parasita da malária nos mosquitos, provando que o mosquito é o vector da malária em humanos ao mostrar que determinadas espécies de mosquitos transmitem malária às aves. Ross isolou parasitas de malária a partir das glândulas salivares dos mosquitos que se tinham alimentado de aves infectadas.[123] Em 1902, Ross foi agraciado com o Nobel de Medicina. Depois de se demitir do Serviço de Medicina indiano, Ross foi admitido na nova Escola de Medicina Tropical em Liverpool, onde administrou campanhas de controlo da malária no Egito, Panamá, Grécia e Maurícia.[124] As descobertas de Finlay e Ross foram confirmadas em 1900 por uma comissão médica presidida por Walter Reed, cujas recomendações foram implementadas durante a construção do canal do Panamá. Esta estratégia pioneira salvou a vida a milhares de trabalhadores e ajudou a definir os métodos usados em futuras campanhas de saúde pública contra a doença.[125]
O primeiro tratamento eficaz para a malária surge a partir da casca do arbusto cinchona, a qual contém quinino. Este arbusto cresce nas encostas dos Andes, sobretudo no Peru. Os índios peruanos faziam uma tintura de cinchona para o tratamento da febre. Descobriu-se que era eficaz contra a malária e, por volta de 1640, foi introduzida pelos Jesuítas na Europa. Em 1677 estava já inscrita na farmacopeia de Londres enquanto tratamento antimalárico.[126] No entanto, foi apenas em 1820 que o princípio ativo, o quinino, foi extraído da casca, isolado e batizado pelos químicos franceses Pierre Joseph Pelletier e Joseph Bienaimé Caventou.[127][128]
O quinino tornou-se o principal medicamento antimalárico até à década de 1920, quando se começaram a desenvolver novos fármacos. Na década de 1940, o quinio é substituído pela cloroquina enquanto tratamento de eleição caso não se verifique resistência, tanto para a malária não complicada como para a malária grave. A cloroquina começou a ser usada no Sudeste Asiático e na América do Sul na década de 1950, e em todo o mundo na década de 1980.[129] A atemisinina, descoberta a partir da planta Artemisia annua pela equipa do cientista chinês Tu Youyou na década de 1970, tornou-se o tratamento recomendado para a malária falciparum, administrado em associação com outros fármacos.[130]
O Plasmodium vivax foi usado entre 1917 e a década de 40 na malarioterapia – a injeção propositada de parasitas da malária de modo a induzir febre para combater determinadas doenças como a sífilis. Em 1917, o inventor desta técnica, Julius Wagner von Jauregg, recebeu o Nobel de Medicina. No entanto, a técnica era perigosa, matando cerca de 15% dos pacientes, pelo que deixou de ser usada.[131]
O primeiro pesticida usado para a vaporização residual interior foi o DDT.[132] Embora inicialmente fosse usado em exclusivo para combater a malária, rapidamente começou a ser usado também na agricultura. Com o decorrer do tempo, o produto passou a ser usado principalmente para o controlo de pragas em larga escala, o que provocou a resistência dos mosquitos ao pesticida em inúmeras regiões. Durante a década de 1960, aumentou a consciencialização pública do impacto negativo do seu uso indiscriminado, o que levaria na década seguinte à interdição do DDT na agricultura em vários países.[57] Antes do DDT, nas áreas tropicais como o Brasil ou o Egito, a malária era eliminada ou controlada através da remoção ou envenenamento dos habitats de reprodução do mosquito ou dos habitats aquíferos das larvas ao aplicar, por exemplo, o composto altamente tóxico Verde de Paris em águas estagnadas.[133]
A investigação procura ainda uma vacina contra a malária. Os primeiros estudos promissores que demonstraram o potencial para a possibilidade de uma vacina foram realizados em 1967, através da inoculação de ratos com esporozoítos vivos atenuados por radiação, os quais ofereceram proteção significativa perante injeções posteriores com esporozoítos normais. Desde a década de 1970 que tem havido esforços consideráveis no sentido de desenvolver uma estratégia de vacinação semelhante em seres humanos.[134]
Sociedade e cultura[editar | editar código-fonte]
Impacto económico[editar | editar código-fonte]
A malária não é apenas uma doença associada à pobreza; algumas conclusões sugerem que a própria doença seja uma das causas de pobreza e um entrave significativo ao desenvolvimento económico.[9][10] Embora as regiões mais afetadas sejam as tropicais, a malária atinge também regiões temperadas com alterações sazonais profundas. A doença tem vindo a ser associada a efeitos nefastos muito significativos na economia das regiões onde está disseminada.[135] Em 1995, a comparação do PIB per capita, corrigido pela paridade do poder de compra, entre países com malária e países sem malária indicou uma diferença na proporção de um para cinco (1 526 $ e 8 268 $, respetivamente). No período entre 1965 e 1990, nos países onde a malária era endémica o crescimento económico do PIB ‘’per capita’’ foi, em média, de apenas 0,4% ao ano, em contraste com os 2,4% dos restantes países.[136]
A pobreza pode aumentar o risco de malária, uma vez que aqueles que vivem na pobreza não têm recursos financeiros para prevenir ou tratar a doença. Estima-se que o custo global do impacto da malária em África seja anualmente de 12 mil milhões de dólares. O impacto económico engloba as despesas com cuidados de saúde, dias de trabalho perdidos, dias perdidos na educação, diminuição da produtividade devido às lesões cerebrais e perda de receitas de investimento e de turismo.[11] A doença representa um fardo pesado para alguns países, nos quais é responsável por 30-50% dos internamentos hospitalares, até 50% dos doentes de ambulatório, e até 40% da despesa pública de saúde.[137]
A malária cerebral é uma das principais causas de deficiências neurológicas em crianças africanas.[88] Os estudos comparativos de funções cognitivas antes e após o tratamento para a malária grave continuam a demonstrar a diminuição do desempenho escolar e das capacidades cognitivas, mesmo após o recobro.[87] Assim, a malária grave e cerebral representam consequências sócio-económicas que se prolongam muito para além das consequências imediatas da doença.[138]
Contrafação e falsificação de medicamentos[editar | editar código-fonte]
Têm sido encontrados diversas contrafações sofisticadas de medicamentos provenientes de vários países asiáticos como o Camboja,[139] China,[140] Indonésia, Laos, Tailândia e Vietname. Estas falsificações são responsáveis por mortes de outra forma evitáveis nesses países.[141] A OMS refere que há estudos que estimam que até 40% dos medicamentos de malária à base de artesunato sejam contrafeitos, sobretudo na região do Grande Mekong, tendo implantado um sistema de alerta rápido que permite que a informação sobre medicamentos contrafeitos seja rapidamente reportada às autoridades dos países aderentes.[142] Não existe um método eficaz que permita aos médicos ou à população em geral detectar medicamentos de contrafação sem a ajuda de um laboratório. As farmacêuticas combatem o aumento de fármacos falsificados com o recurso a novas tecnologias que ofereçam maior segurança desde a fonte à distribuição.[143]
Outro problema de saúde clínica e pública é a proliferação de medicamentos anti-maláricos de qualidade inferior, os quais resultam da concentração inapropriada de ingredientes, contaminação com outros fármacos ou impurezas tóxicas, ingredientes de fraca qualidade, pouca estabilidade e embalamento inadequado.[144] Um estudo de 2012 demonstrou que cerca de um terço dos medicamentos anti-maláricos no Sudeste Asiático e na África subsariana ou eram falsificados ou não passavam nos exames químicos e padrões de embalagem.[145]
Estratégias de erradicação[editar | editar código-fonte]
Têm sido realizadas diversas tentativas notáveis com o intuito de eliminar o parasita de várias partes do mundo, ou de o erradicar por completo. Em 2006, a organização Malaria No More anunciou o objetivo de erradicar a malária de África em 2015.[146] Existem várias vacinas em fase de ensaio clínico, destinadas a proporcionar proteção para as crianças de regiões endémicas e reduzir a velocidade de transmissão da doença. Em 2012, o Fundo Global de luta contra a SIDA, Tuberculose e Malária distribuiu 230 milhões de redes tratadas com inseticida destinadas a impedir a transmissão através da picada do mosquito.[147]A norte-americana Fundação Clinton tem trabalhado para gerir a procura e estabilizar preços no mercado da artemisinina.[148] Outros projetos, como o Projeto do Atlas da Malária, estão focados na análise de dados climáticos e meteorológicos que permitam prever a propagação de malária com base na disponibilidade de habitats para os vectores de parasitas.[149]
A malária já foi erradicada ou bastante reduzida em determinadas regiões. A doença já foi comum nos Estados Unidos e na Europa do sul, mas as iniciativas de controlo de vectores em conjunto com a monitorização e tratamento de indivíduos infetados, proporcionaram a sua erradicação. Para tal contribuíram vários factores: a drenagem de terrenos alagados para agricultura, diversas alterações nas práticas de gestão de recursos hídricos, generalização do saneamento e uso de janelas de vidro e redes mosquiteiras nas habitações.[150] Os mesmos métodos permitiram erradicar a malária da maior parte dos Estados Unidos no início do século XX, restando apenas nalguns focos no Sul, tendo sido erradicada por completo na década de 1950 com recurso a DDT.[151] No Suriname, a doença foi erradicada da capital e regiões costeiras em 1955 através de um programa que consistia em três medidas: controlo de vectores através do uso de DDT e vaporização residual; recolha regular de amostras de sangue da população para identificar casos da doença; e tratamento com quimioterapia para todos os infetados.[152] O Butão tem implementada uma estratégia agressiva de erradicação, tendo conseguido entre 1994 e 2010 uma redução de 98,7% dos casos confirmados através de microscopia. Estas metas foram conseguidas com recurso a técnicas de controlo de vectores, como a vaporização residual em áreas de risco e através da distribuição de redes tratadas com pesticidas, auxiliadas pelo desenvolvimento económico e melhoria no acesso a serviços de saúde.[153]
Investigação[editar | editar código-fonte]
A imunidade (ou, mais precisamente, a tolerância imunológica) à malária P. falciparum pode ocorrer naturalmente, mas apenas enquanto resposta a anos de infeções repetidas.[154] Um indivíduo pode ser protegido contra uma infeção P. falciparum se receber cerca de mil picadas de mosquitos contaminados com uma versão não infetiva do parasita, inoculada por raio X.[155] Não está ainda disponível qualquer vacina para a malária, embora estejam a ser desenvolvidas.[156] A natureza extremamente polimórfica de muitas das proteínas P. falciparum representa um desafio significativo para a criação de uma eventual vacina. Os candidatos a vacina que têm por alvo os antígenos nos gâmetas, zigotos ou oocinetos no sistema digestivo do mosquito pretendem bloquear a transmissão de malária. Estas vacinas induzem anticorpos no sangue humano; quando o mosquito se alimenta do sangue de um indivíduo inoculado, os anticorpos impedem o parasita de concluir o seu desenvolvimento no mosquito.[157] Outros candidatos, que têm como alvo a fase sanguínea do ciclo de vida do parasita, têm-se mostrado inadequadas.[158] Por exemplo, a SPf66 foi amplamente testada em áreas endémicas na década de 1990, mas os ensaios clínicos demonstraram não ser suficientemente eficaz.[159] Estão em desenvolvimento potenciais vacinas que têm por alvo a fase pré-eritrócita do ciclo de vida do parasita, sendo a RTS,S a principal candidata;[155] estando previsto o seu licenciamento em 2015.[160] Está também a ser desenvolvida uma vacina atenuada pré-eritrocíta denominada PfSPZ que usa esporozoítos completos para induzir uma resposta imune.[161] Em 2006, a OMS delineou uma orientação ("Malaria Vaccine Technology Roadmap") em que um dos principais objetivos para 2015 é o "desenvolvimento e licenciamento de uma vacina de primeira geração contra a malária que tenha uma eficácia de proteção superior a 50% contra a forma grave da doença e a morte, e cuja duração seja superior a um ano."[162]
Os parasitas de malária contêm apicoplastos, organelas geralmente presentes nas plantas, completos com o seu próprio genoma. Pensa-se que estes apicoplastos se tenham formado a partir da endossimbiose de algas e desempenham um papel crucial em vários aspetos do metabolismo do parasita, como por exemplo na biossíntese de ácidos gordos. Foram identificadas mais de 400 proteínas produzidas pelos apicoplastos, e que estão agora a ser investigadas enquanto possíveis alvos de novos fármacos antimaláricos.[163] O plasmodium também fabrica moléculas de odor atrativo, chamados terpenos. Ele faz isso usando uma organela semelhante ao cloroplasto, como aquele que as plantas usam para captar a luz solar. A versão do parasita da malária não pode capturar luz, mas ele ainda pode fabricar perfume.[164]Os parasitas, no laboratório, produzem esses perfumes e os mosquitos são atraídos por eles. Os cientistas estão tentando descobrir se essas substâncias químicas também aparecem na respiração dos seres humanos infectados. Se o fizerem, o objetivo dos cientistas é criar um bafômetro para a malária, em vez de o exame de sangue usado hoje.[165]
Com o aparecimento de cada vez mais parasitas Plasmodium resistentes, estão a ser desenvolvidas novas estratégias para combater a disseminação da malária. Uma destas estratégias consiste na introdução de adutos sintéticos de aminoácidos piridoxais, que são recolhidos pelo parasita e interferem com a sua capacidade de criar vitaminas Bessenciais.[166][167] Estão também a despertar interesse os fármacos antimaláricos à base de complexos sintéticos de base metálica.[168][169]
Outra estratégia de controlo de vetores não química envolve a manipulação genética de mosquitos de malária. O progresso na tecnologia de engenharia genética tornou possível introduzir ADN externo no genoma do mosquito, diminuindo a sua esperança de vida ou tornando-o mais resistente ao parasita da malária.[59] A técnica do inseto estéril é um método de controlo genético pelo qual são criadas grandes quantidades de mosquitos machos estéreis, que depois são libertados. O acasalamento com fêmeas reduz a população em estado selvagem na geração seguinte, e a libertação sucessiva eventualmente erradica a população-alvo.[59]
Em 2017, dois pesquisadores da Stanford criaram a centrífuga de papel que pode revolucionar como infecções como malária e HIV são detectadas nos países em desenvolvimento[170].
Em animais[editar | editar código-fonte]
Estão identificadas cerca de 200 espécies parasíticas de Plasmodium capazes de infetar aves, répteis e outros mamíferos,[171] e cerca de 30 espécies que infetam naturalmente outros primatas para além do ser humano.[172] Alguns dos parasitas de malária que afetam outros primatas funcionam como organismos modelo para os parasitas humanos; por exemplo o P. coatneyi é um modelo para o P. falciparum e o P. cynomolgi para o P. vivax. As técnicas de diagnóstico usadas para detectar parasitas em primatas são semelhantes às usadas para detectar em humanos.[173] Os parasitas de malária que afetam roedores são amplamente usados como modelos na investigação, como por exemplo o P. berghei.[174]A malária aviária afeta principalmente as espécies da ordem dos Passeriformes, e constitui uma ameaça significativa para as aves de arquipélagos como as Galápagos ou o Havai. Sabe-se, por exemplo, que o parasita P. relictum desempenha um papel na limitação da distribuição e abundância das aves endémicas do Havai. Prevê-se que o aquecimento global aumente a prevalência e distribuição mundial da malária aviária, à medida que a subida da temperatura proporciona condições ótimas para a reprodução do parasita.[175]